
Гомеопатия
Одесские крупинки или globuli по-одесски.
У нас целый мир гомеопатии. Лечение гомеопатией в Одессе, ул. Тираспольская, 13 Центральная Одесская гомеопатическая аптека (аптека №5 ОАО "Фармация"). У нас Вы найдете все гомеопатические препараты. Узнаете о классической гомеопатии и все о последних форумах и семинарах по гомеопатии.

|
Поиск:
Гомеопатия - это...
Карта сайта
Написать письмо врачам
Написать письмо в аптеку
Правила записи на консультации врачей
Публикации по гомеопатии
Materia Medica динамизированных лекарственных препаратов...
История и практика использования биотерапевтических средств...
Гомеопатические средства в неврологии и медицинской реабилитации...
Препараты из насекомых...
Периодические профессиональные издания
Международные новости
Семинары, конференции, форумы
Одесские Гомеопатические Конгрессы
И снова о фаршированной рыбе
Объявления для гомеопатов
События, даты, поздравления и комментарии
Книги и журналы для гомеопатов
Новые издания по гомеопатии
Одесское гомеопатическое общество
Анкеты консультантов и лекторов Общества
Одесская гомеопатическая аптека
История аптеки
Номенклатура динамизированных средств
Монокомпонентные средства
Сверхвысокие разведения ГЛС
Многокомпонентные динамизированные средства
Изготовление гомеопатических лекарств
История гомеопатии в регионе
Materia medica
Гомеопатия для чайников
Вопрос - ответ
Дружественные сайты
|
Safety issues in the preparation of homeopathic medicines (WHO) The material contains the most important document of WHO (World Health Organization) until today on safety of homeopathic medicines accepted and published in 2010. About 400 experts and organizations participated in the work on the document. Each of the sections contains the necessary references and bibliography. Ключевые слова: гомеопатия, гомеопатические средства, глоссарий, технология, терминология Key words: homeopathy, homeopathic remedies, glossary, technology, terminology Предисловие
Гомеопатия – это система медицины, рождённая в Европе в последней части XVIII века. Врачи-гомеопаты используют гомеопатические средства, которые приготовлены по чётко определённым процедурам, начиная с веществ, извлечённых из минералов, трав и животного мира. Методы приготовления этих средств включают разведение сырья в водно-спиртовых растворах или в других носителях, и потенциирования продукта в разных степенях. В некоторых случаях разведение настолько высоко, что почти невозможно найти одну молекулу первоначально сырья. Конечно, этот факт вызвал интенсивную дискуссию между, с одной стороны, людьми, которые испытывали положительные влияния гомеопатической терапии и очень верят в неё и, с другой стороны, людьми, которые критикуют эти продукты, как противоположные всем требованиям современной фармакологии.
Использование гомеопатических средств расширялось всё более и более, и в наше время, они широко распространены не только в Европейской зоне, но также в Южноазиатских странах, и в странах Северной и Южной Америки. С ростом использования гомеопатических средств и быстрым расширением мирового рынка, их безопасность и качество стали главной заботой Министерств здравохранения, фармацевтической промышленности и потребителей. Безопасность гомеопатических средств, главным образом, зависит от их качества. Требования и методы контроля качества готовых гомеопатических средств более сложны, чем у химических лекарств, особенно для комплексных (смешанных) средств. Более того, на качество гомеопатических средств влияет как качество процедуры, используемой во время их производства, так и качество сырья. Продукты, которые соотвествуют стандартам высокого качества, необходимы для того, чтобы пациент мог безопасно использовать гомеопатические средства. В наше время это всё более и более важно, так как, вследствие глобализации рынка, много сырья и лекарств, используемых в системе гомеопатии, проступают из разных стран.
В Ломбардии до 20% населения регулярно используют гомеопатические средства, но почти 60% населения используют их, время от времени, для здоровья и благополучия, и эти цифры возрастают. Кроме того, более 34% людей используют гомеопатические средства для самолечения. Конечно, этим людям нужно гарантировать такой же высокий уровень качества и безопасности, который предложен всем жителям Ломбардии. С 2002 г. план здравоохранения области Ломбардия поддерживает принцип свободы выбора среди разных вариантов лечения.
В нынешней ситуации, для защиты потребителей, весьма важны гарантии основных требований для гомеопатических средств на международных, национальных и региональных уровнях. По этой причине, правительство Ломбардии обеспечивает поддержку сотрудничества с ВОЗ для развития этого технического документа, чтобы гарантировать, что гомеопатические средства соответствуют минимальным нормам, и гарантируют высокое качество таких средств, как в Ломбардии, так и во всём мире. В дополнение, мы желаем, чтобы этот технический документ использовали как справочный, для того, чтобы облегчить внедрение правил в тех странах, где их ещё нет. Этот документ может также быть использован для того, чтобы граждане знали о безопасности и качестве гомеопатического лекарства.
Лючиано Бресциани и Джулио Боскагли (Региональное правительство Ломбардии)
Предисловие
Лекарства из трав все больше и больше используют за последние три десятилетия. Например, в Европе, в 2003 году, их реализация принесла 5 миллиардов USD. Стоимость традиционных китайских лекарств, используемых в Китае, в 2008 составила 26 миллиардов USD. Продажа своих традиционных лекарств в Японии, известных как лекарства kampo, достигла почти 1 миллиарда USD в 2007 году.
Гомеопатия - одна из самых используемых форм растительных лекарств. В мире существует крупный рынок сбыта гомеопатических продуктов. Например, в 2008 г. Австралия потратила 7,3 миллиона USD на гомеопатические средства; Франция - более 408 миллионов; Германия - 346 миллионов, и Соединённое Королевство - более 62 миллионов USD. В США взрослое население потратило 2,9 миллиарда долларов на гомеопатические продукты в 2007 году.
Понимая важность гомеопатических средств, Министерства Здравохранения и потребители, вполне естественно, озабочены их безопасностью. Так как гомеопатические средства обычно назначают в очень высоком разведении, и ингредиенты не могут быть обнаружены или подсчитаны в конечных продуктах, считают, что гомеопатические средства часто не представляют проблем относительно безопасности. Тем не менее, есть несколько аспектов в производстве гомеопатических средств, которые могут представлять потенциальный вред их безопасности. Во-первых, не все гомеопатические средства назначают в высоком разведении. Иногда гомеопатическое средство, сделанное от исходного материала, такого как материнская настойка, назначают в концентрированной форме. Во-вторых, гомеопатические средства делают из разнообразных натуральных или синтетических источников: минералы и химикаты; а также растительные материалы, включая корни, стебли, листья, цветы, кору, пыльцу; лишайники, мхи, папоротники и водоросли; микроорганизмы, включая грибки, бактерии, вирусы и паразиты растений; органы, ткани, секрет и колонии клеток животных. Человеческий материал может включать ткани, секрет, гормоны и колонии клеток. Некоторые из этих исходных материалов создают потенциальную опасность для безопасности средств, даже в высоких разведениях.
Резолюция по традиционной медицине, принятая Всемирной Ассамблеей Здоровья (WHA) в мае 2009 г. (WHA 62.13), советует государствам-членам «формулировать национальную политику, правила и стандарты, как часть всесторонних национальных систем здравоохранения, для того, чтобы расширить правильное, безопасное и эффективное использование традиционной медицины»; и призывает ВОЗ «продолжать обеспечивать техническое руководство для поддержки стран в обеспечении безопасности, эффективности и качества традиционной медицины». Это применимо и к гомеопатическим средствам, и данный документ поможет выполнять рекомендации, определяя потенциальные вопросы безопасности, связанные с производством гомеопатических средств. В то же время, он пытается достичь определённого консенсуса о терминологии определения гомеопатических средств, для того, чтобы рекомендовать безопасные степени разведений гомеопатических препаратов, расширить обмен информацией.
В подготовке этого документа ВОЗ консультировали более чем 400 рецензентов из 105 стран, включая специалистов в области гомеопатических средств, растительных препаратов, биологической и фармацевтической продукции, членов экспертной консультативной группы ВОЗ по традиционной медицине, членов экспертной консультативной группы ВОЗ по международной фармакопее и фармацевтическим препаратам, и центров сотрудничества ВОЗ по традиционной медицине, а также соответствующие неправительственные организации. Национальные органы контроля более чем в 100 странах получили проекты документа для ознакомления и получения дополнительной информации, комментариев и консультаций.
Документ предназначен для поддержки национальных органов контроля, изготовителям гомеопатических средств, - в целях обеспечении безопасности и качества гомеопатических средств. Национальные органы власти могут использовать его как справочную информацию, устанавливая соотвествующие регламентирующие требования. Документ предусматривает определения общеиспользуемых технических терминов в отношении качества гомеопатических средств. Его порекомендовал Симпозиум по гомеопатии на 10-й Международной конференции по контролю за лекарствами (ICDRA) в 2002 г., проведенной в Гонконге, особой административной области Китайской Республики, и должен облегчить контроль за качеством.
Др. Xiaorui Zhang, координатор по традиционной медицине
Отдел управления системы здоровья и оказания услуг ВОЗ
1. Введение
Термин гомеопатия произошёл от греческих слов (homoios: подобно) и (pathos: страдание, заболевание). Гомеопатия имеет целостный (холистический) подход к излечению, со своим главным принципом, который гласит «подобное лечит подобное» (по латыни: curentur similibus similia). Гомеопатия имеет свои собственные взгляды на болезни, свои принципы диагностики и лечения, а также продукты и практику. Основанная в 1796 г. немецким врачом Самюэлем Христианом Ганеманом, она лечит пациентов сильно разведенными препаратами из веществ, которые, в их неразведенной форме, как считают, вызывают влияния, подобные представленным симптомам. Гомеопатические лечебные продукты также используют в других терапевтических подходах, с разным эпистемологическим и методологическим состоянием, таких как антропосоматическая медицина, гомотоксикологическая/антигомотоксическая терапия и изотерапия.
Гомеопатию широко использют во всех регионах действия ВОЗ. Национальные регламентационные рамки и место гомеопатии внутри систем здравоохранения отличны в разных странах, но использование гомеопатических препаратов, главным образом, как безрецептурных средств, растёт во многих частях мира. Точный объём рынка гомеопатических средств (ГС) в экономических терминах неизвестен, но данные продаж показали, что ГС представляют важную часть медицинской экономики. Несмотря на растущее использование ГС во всём мире, мало кто из государств-членов ВОЗ регулируют их. Считают само собой разумеющимся, что безопасность ГС не должна быть особой заботой, так как они часто сильно разведены при назначении. Однако, это не всегда так. Более того, разнообразие используемых материалов (лекарственные растения, материалы животных и человека, патогены, а также минералы и химикаты), и другие технические аспекты производства и изготовления ГС, могут представлять потенциальный риск их безопасности.
Неблагоприятные реакции, происходящие во время гомеопатического лечения, редко приписывают самим ГС. Однако, оценка безопасности должна также рассматривать возможные примеси (или загрязнения) в исходном материале, и плохую практику изготовления. Кроме того, так как многие ГС можно купить как безрецептурные лекарства в аптеках и магазинах здоровых продуктов, без консультации со специалистом-медиком, стало очень важным обеспечение достаточной и доступной информации о таких препаратах. Хотя признано, что ГС обычно доброкачественны, уровень санкции, соотвествующее обозначение и обеспечение качества следует принимать в расчёт при их широком использовании также и внутри уязвимых слоёв населения (пожилые люди, беременные женщины, дети). В последние годы были ряд обращений в ВОЗ для того, чтобы поддержать усилия для урегулирования безопасности ГС.
Традиционная стратегия ВОЗ 2002-2005 гг. касательно лекарств, и стратегия на период 2004-2007 гг. - обе касаются безопасности, качества и эффективности традиционной медицины (TM), а также комплементарной и альтернативной медицины (СAM). Развитие технического руководства относительно безопасности и проверки качества растительных средств и других продуктов TM/СAM было ключевым положением этих стратегий. 10-я Международная конференция органов контроля лекарств (ICDRA), прошедшая в июне 2002 г. в Гонконге, особой административной области Китая, попросила ВОЗ: «Согласовать определения ГС; [создать] рекомендации для безопасных степеней разведений гомеопатических препаратов; обеспечить обмен информацией и обеспечить правительственными [неправительственными организациями] NGOs обучение гомеопатической медицине» (1).Наконец, решение WHA 56.31 по традиционной медицине, принятое в 2009 г. на Всемирной Ассамблее Здоровья, попросило ВОЗ обеспечить технической поддержкой развивающиеся методологии для того, чтобы обеспечить качество продукции, эффективность и безопасность.
Данный технический документ является ответом ВОЗ на эти просьбы и рекомендации, и частью выполнения Стратегии традиционной медицины и Стратегии по использованию лекарств ВОЗ. Его цель - обеспечение государствчленов руководством по техническим аспектам производства и изготовления ГС, что потенциально имеет связь с их безопасностью. Это важно для установления национальных стандартов качества и спецификации для ГС, а также для контроля их качества. Документ, однако, не касается вопросов эффективности или клинического использования.
Гомеопатия использует специфическую терминологию, не всегда последовательно применяемую в монографиях и в нынешних вариантах фармакопей, используемых официально. В этом документе обязательно нужно определить точно выраженные ключевые термины: без этого рекомендации по проверке качества трудно выполнить. Термины, используемые в документе, определены в Приложении 2. Эти определения получили одобрение, и достаточно обширны, чтобы включать ГС, произведенные и используемые, согласно установленным изменениям к первоначальной философии Ганемана (относимые к сложным ГС и тем, которые названы гомеотерапией). Терминология использована последовательно, как определено в Приложении; это необходимо для единого и точного упорядочивания ГС.
Документ составлен в 3-х частях. Первая рассматривает специфичность ГС, показывая тип потенциальных проблем безопасности, которые они могут представлять, и проверку качества, призывая рассмотреть эти данные. Следующая глава рассматривает специфические аспекты безопасности, отнесенные к материалам и ингредиентам, используемым в приготовлении ГС. Последняя часть рассматривает нормативные вопросы, связанные с изготовлением и процессами маркетинга, информацией потребителю. За главной частью документа идет словарь технической терминологии по теме и комплементарным материалам.
2. Проблемы проверки качества гомеопатических средств
2.1 Гомеопатия и гомеопатические средства
Центральный принцип гомеопатии («подобное лечит подобное» - лат.: curentur similibus similia), основан на целостном (холистическом) подходе к тотальности симптомов пациента. ГС основаны на принципе, что высокие разведения потенциально активных молекул сохраняют память изначального вещества. Следовательно, первоначальные материалы, гомеопатический ассортимент и/или материнские настойки подвергают процессу серийных разведений и встряхиваний для того, чтобы потенциировать продукт с инертным материалом. Первоначально, Ганеман использовал этот процесс для снижения токсичности потенциально опасных веществ. Название потенциирование для обозначения этого процесса он дал позднее.
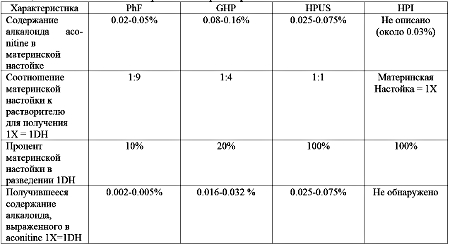
С точки зрения безопасности, важно сначала отметить, что, хотя гомеопатическое лечение часто использует ультрамолекулярные разведения первоначального материала (выше числа Авогадро), есть также ГС значительно более низких разведений, содержащие молекулы, которые могут быть активны в биохимическом смысле. Следовательно, хотя считают, что ГС, в общем, безопасны, если их назначили правильно, токсикологические аспекты не должны быть упущены, особенно при использовании более низких разведений опасного первоначального материала. Более того, количество изначального материала, присутствующее в ГС, может зависеть от метода приготовления. Вопросы безопасности могут возникнуть, если такие различия упущены. Сравнение «идентично» озаглавленных фармакопейных статей по Aconitum napellus в разных фармакопеях, например, во Французской Фармакопее (PhF) (2), Немецкой гомеопатической Фармакопее (GHP) (3), Гомеопатической Фармакопее США (HPUS) (4) и Гомеопатической Фармакопее Индии (HPI) (5), показывает значительные различия (Таблица 1). Aconitum Napellus 1X=1DH, приготовленный согласно GHP, ближе к материнской настойке Aconitum napellus, чем 1X=1DH, приготовленный согласно PhF. В случае Индии содержание алкалоидов не определено, так как члены Фармакопейного Гомеопатического Комитета (HPC) полагают, что небольшие изменения в количестве физиологически активных алкалоидов в конечном продукте не имеют никакого последствия для действия средства. Они рассматривают его действие как качественное, на нефизиологическом уровне, а не количественное (дозазависимое).
Таблица 1. Статьи по Aconitum napellus в четырёх Фармакопеях
 2.2 Вопросы потенциальной безопасности
Есть 2 основные группы потенциальной опасности: группа, которая связана с исходным материалом, и та, что связана с процедурами, используемыми для изготовления законченного продукта.
Гомеопатические средства или их сырье/материнские настойки готовят из естественных или синтетических источников, которые упоминают в фармакопеях или других признанных документах. Без учёта предвходящих, исходные материалы для ГС могут состоять из следующего:
• материалы растений, такие как: корни, стебли, листья, цветки, кора, пыльца, лишайники, мхи, папоротники и водоросли;
• микроорганизмы, такие как: грибки, бактерии, вирусы и паразиты растений;
• животные материалы, такие как: целое животное, органы животных, ткани, секрет, колонии клеток, токсины, нозоды, продукты крови;
• человеческие материалы, такие как: ткани, секрет, колонии клеток и эндогенные молекулы, такие как гормоны;
• минералы и химикаты.
Важно качество исходных материалов и носителей, используемых в изготовлении ГС. ГС могут содержать материал из сомнительных источников, использование которых обычно ограничено: нозоды состоят из разведений патогенных органов или тканей; возбудителей болезней, таких как бактерии, грибки, яйца, паразиты, частицы вирусов и дрожжи; продуктов болезни; выделений или секретов. Все материалы животного или человеческого происхождения имеют риск содержания патогенных веществ. ГС могут быть основаны на токсических исходных материалах из животных или растений, в то время как другие, особенно в свежей форме, склонны к процессам распада или микробиологическому загрязнению. Материалы из растений могут быть загрязнены пестицидами и тяжёлыми металлами. Содержание токсических составов в материалах из растений может значительно варьироваться.
Директивы по надлежащей производственной практике (GMP) включают: процесс производства, помещения, персонал, упаковку и маркировку, применяемую для гомеопатических средств, а также для обычной фармацевтической продукции. Отказ от GMP может вызвать тревогу по поводу качества и безопасности средств, как, например, ошибочное применение, примесь к первоначальному материалу, перекрестное заражение или случайное загрязнение.
Уникальные характеристики изготовления ГС имеют ряд особых значений, и требуют особо квалифицированного и опытного персонала. Они касаются токсичных материалов, особенно свежих, которые склонны к процессам разрушения и микробному загрязнению; и ГС, источники получения которых - животные или человек. На свойства ГС могут повлиять случайное или преднамеренное загрязнение исходных материалов, носителей или растворителей, сосудов или флаконов, в которых сделаны разведения. Поэтому определения могут варьироваться в Фармакопеях, и из-за широкого диапазона методов обработки и процессов производства в различных странах; окончательные гомеопатические продукты могут показывать явные отличия и изменения.
2.3 Возможности контроля качества
Необходимо, чтобы изготовители лицензированных средств доказали, что их продукты соотвествуют основным стандартам качества и соответствуют директивам GMP. Это же относится и к лицензированным ГС. Большинство изготовителей ГС уже приняли необходимые меры по обеспечению качества, и готовят средства согласно принципам GMP. Но это не всегда так в странах, где продукция ГС не подлежит лицензированию. Помимо директив GMP, особые характеристики ГС необходимо проверять на качество. Во-первых, по ряду технических директив ВОЗ в отношении обеспечения качества и контроля над применением средств растительного происхождения (6,7,8-12). Во-вторых, специфическая природа ГС нередко имеет, как следствие, непригодность и нерелевантность для некоторых из методов проверки качества и некоторые тестсистем, которые необходимы по фармацевтической инструкции (включая идентификацию и квантификацию активных веществ, токсикологическое тестирование окончательного гомеопатического продукта). Идентификация образцов исходных материалов невозможна при высоких потенциях. В таких случаях качество должно быть продемонстрировано полной легализацией процессов изготовления и процесса разведения.
3. Вопрос контроля качества гомеопатических средств
ГС часто готовят из природных исходных материалов. Два вопроса важны для качества гомеопатических препаратов: определение подлиности и происхождения первоначальных материалов согласно гомеопатической традиции, и определение процедуры изготовления. Пока есть подлинность и очищенность первоначальных материалов, и воспроизводимость процесса производства, естественные биологические и географические вариации первоначальных материалов будут неотъемлемой частью качества ГС. Проверку подлинности и очищенности обычно выполняют у первоначального материала, и при наименьшем разведении источника, используемого для потенциирования (например, материнские настойки). Соответствие качества продукции обеспечивают: путём определения соотвествующих спецификаций, особенно для первоначальных материалов; и путём определения процедур изготовления, унифицированных согласно официальным гомеопатическим Фармакопеям и другим официально признанным документам, утверждённым согласно GMP. Разнообразное происхождение сырья, используемого в производстве ГС, требует ряда подходов для обеспечения безопасности конечного продукта. В общем, контроль качества должна включать идентификацию и, если применимо, квантификацию материалов до обработки; использовать утверждённые методы и подходящие аналитические тесты на подлинность источника, возможные загрязнения и токсичные компоненты (тесты должны иметь фармакопейный или равноценный статус) (13-15).
Сырьё, используемое для гомеопатических препаратов, должно быть описано для того, чтобы определить, где применимо, происхождение, историю и природу первоначального материала:
• если ботанического происхождения: научное имя - род, вид, подвид/разновидность, авторитетный источник, семейство (перекрестная ссылка на общее название); другая соответствующая информация (экотип, хемотип и фенотип); используемая часть; состояние материала; возможные фармакологически активные или токсичные компоненты; макроскопическое и микроскопическое описание;
• если биологического происхождения: физическое, анатомическое и гистологическое состояние; и
• если минерального или химического происхождения: физическая форма, структурная формула и относительная молекулярная масса.
3.1 Материал из растений
Когда использют материал из растений, то все вещества (включая части растений, соки или обрабатываемые материалы) должны отвечать национальным стандартам качества и спецификациям, фармакопейным аналитическим требованиям и статьям. В дополнение к фармакопейным справкам по проверке качества и аналитическим тестированиям растительных материалов, другие директивы и руководства также могут быть рассмотрены (6,7,8-12,15-18).
Из-за сложной и изменчивой природы растительного материала, и его возможного загрязнения микробами, насекомыми, пестицидами, тяжёлыми металлами, фумигантами, микотоксинами и радиацией, адекватный контроль исходного материала, хранение и обработка становятся особенно важными, когда растительные материалы используют в изготовлении ГС.
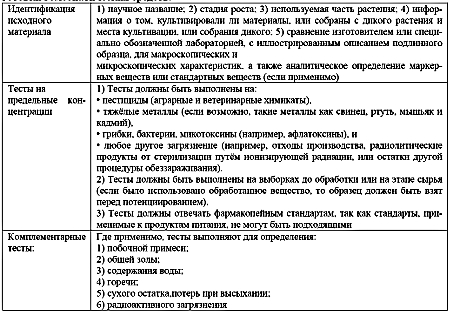
Изготовителей призывают следовать примерным стандартам и условиям относительно подлинности исходного материала, тестов на предельное количество и комплементарных тестов. Они даны в таблице 2.
Чёткое описание следующих характеристик должно сопровождать каждую серию, а его отсутствие должно быть оправдано:
• части/используемый материал растения; макроскопическое описание растения и растительного материала;
• микроскопические характеристики;
• тесты на подлинность;
• тесты на очищенность;
• содержание влаги/воды;
• определение содержания токсических компонентов (если применимо);
• метод подготовки материнской настойки.
Таблица 2. Условия проверки качества растительного материала, используемые для подготовки гомеопатических средств.
 3.2. Исходный материал из животных и человека
ГС, изготовленные из здоровых или больных животных или человеческих источников, вызывают тревогу о микробиологическом и вирусном загрязнении. Эти вопросы особенно обсуждают, с целью уменьшать риск передающийся губкообразной энцефалопатии (TSE). Глава рабочей группы медицинских агенств по гомеопатическим лекарственным продуктам рассмотрел пункты, которые нужно учитывать для безопасности ГС биологического происхождения (Приложение 3).
Соответствующие и утверждённые процедуры (фильтрация, пастеризация, стерилизация или осаждение), должны быть использованы в зависимости от индивидуального сырья, загрязнения или патогенной нагрузки, особенно для того, чтобы установить первый безопасный уровень препарата. Сам процесс разведения недостаточен для того, чтобы установить безопасность от микробов, вирусов или TSE (Рамка 1). Поэтому, эффективность метода, используемого для того, чтобы исключить патогенные вещества, в дополнение к разведению, должна быть определена и утвержена соотвествующими тестами на предельные концентрации. Если ГС изготовлены из сырых животных продуктов, все возможные пути передачи патогенных веществ следует учитывать в процедурах для обеспечения безопасности. Так как животные органы и секреты имеют разные уровни инфицирования, ткани можно группировать в соответствующие категории (19-21). Только первые безопасные препараты можно распределять как ГС или промежуточные звенья. Они должны соответствовать принципам минимизации риска передачи патогенных веществ (например, стерилизация), учитывая потенциал видовой инфекции, за исключением гомеопатического терапевтического вещества. Определение «первый безопасный препарат или разведение» гарантирует правильное определение вирусных исследований для применения при оценке предполагаемой инфективности. Исследования безопасности, принимая во внимение как вирусные, так и невирусные дополнительные вещества, следует выполнять на этом самом низком уровне, до дальнейших разведений, и/или при производстве других гомеопатических препаратов.
Рамка 1. Управление риском передачи TSE
Использование материалов из животных источников необходимо для ряда ГС. В настоящее время нет свидетельств, что TSE когда-то передавалась при помощи продуктов животного происхождения в лекарствах, включая ГС. Однако, в ответ на всеобщую озабоченность безопасностью, о возможном риске TSE и родственных заболеваний у животных и людей (например, спонгиоидная энцефалопатия быков (BSE), скрепи, болезнь Крейцфельда-Якоба (Creutzfeld-Jacob Disease - CJD), нужно проводить тестирование. Вид животного и его возраст дают важную информацию для оценки риска. Это также относят к носителям, материалам и дополнительным агентам, например, желатину, коллагену, молоку и его продуктам, лецитину, фосфолипидам, аминокислотам и гидролизатам протеина, глицерину и стеаратам. Достаточная и доступная информация необходима для спонсоров и публики, с поддерживаемыми регулярными осмотрами, строгим законодательством по международной торговле и прослеживаемым путём к скотобойне. Чтобы изготовитель и/или спонсор могли сами оценить процессы, и уменьшить риски передачи TSE, следует принять такие меры:
• предпочитать виды животных, не поражённых TSE, или избрать неживотное сырьё;
• использование сильно зараженных тканей необходимо рассматривать в контексте научных данных, и, в частности, возраста животных. Использование такого материала может быть правомерным, когда есть соответствующие документы об оценке риска;
• возможного перекрестного заражения следует избегать путём утверженных процессов очистки;
• предпочтительно использовать молодых животных;
• если есть подозрение, то образцы должны быть представлены в лабораторию до очистки;
• оценку риска нужно выполнить для рассмотрения использования количества животного материала;
• методики работы и источники материала должны быть задокументированы для определения продукта и наличия возможности немедленной реакции в случае любого непредвиденного события Исходные материалы животного просхождения должны отвечать тестам, описанным для выявления:
• загрязнения вирусами, патогенными для людей (например, Европейская фармакопея 6.0 (22), «Гомеопатические препараты», описавшая обращение с исходным сырьём животного происхождения, с чёткими различиями между исходными материалами от здоровых животных);
Чёткое описание следующих характеристик должно сопровождать каждую серию, или его отсутствие нужно объяснить:
• идентификация источника животного материала, включая информацию, где растили животных или их ловили в дикой природе, и место размножения или ловли в дикой природе;
• части/используемый материал животного;
• анатомическое описание части животного;
• гистологическое описание части животного;
• тест на подлинность;
• тест на чистоту;
• содержание влаги/воды;
• определение содержания токсичных компонентов (если применимо);
• метод изготовления первоначального гомеопатического препарата (ссылка на общую процедуру).
Исходный материал человеческого происхождения (ткани, кровь или жидкости) является потенциальным источником инфекции в связи с разнообразием известных и неизвестных передаваемых веществ. Если должен быть использован любой продукт крови, или загрязнение крови возможно, сырьё должно отвечать национальным или официальным директивам (3,23-25). Так как человеческий материал (подобно вытяжке из гипофиза или печени, альбумину или железам) может быть загрязнён бактериями, вирусом или передавать CJD, меры по проверке качества должны затрагивать эти вопросы. Чёткая информация о доноре является предпосылкой обеспечения безопасности ГС человеческого происхождения. Чёткое описание (от тестов и/или информации об истории материала) следующих характеристик должно сопроводить каждую серию, или его отсутствие должно быть оправданным:
• идентификация источника;
• используемый материал;
• анатомическое описание;
• гистологическое описание;
• тест на подлинность;
• тест на чистоту;
• содержание влаги/воды;
• метод изготовления первоначального гомеопатического препарата (ссылка на общую процедуру).
Нозоды. По определению, нозоды включают разведения патогенных органов или тканей; возбудителей (бактерии, грибки, яйца, паразиты, частицы вирусов и дрожжи); продукты болезней; выделения или секреты. Нозоды считают гомеопатическими средствами, если их обработали в соответствии с признанной гомеопатической фармакопеей, используемой официально, или другими официально признаными документами. Из-за их разнообразной природы, рекомендовано, чтобы нозоды изучали индивидуально, для оценки безопасности.
Биотехнологический исходный материал, т.е. материалы, полученные из биотехнически изготовленного или обработанного сырья (колонии клеток, например, человека, животного или растения, микроорганизмы, генетически модифицированные организмы или продукты брожжения) должны отвечать требованиям директив (26-29).
3.3. Минеральный и химический материал
Если минералы или химикаты используют как исходные материалы для изготовления ГС, то нужно проводить аналитические тесты для того, чтобы определить подлинность, источник или происхождение; обнаружить возможное загрязнение тяжёлыми металлами и любыми другими возможными токсичными компонентами. Процедуру по очищению необходимо описать. Для минералов и химикатов данные должны быть об исходном материале; виде и описании исходного материала; тесте на подлинность; тесте на чистоту; и определение содержания. Если эти данные отсутствуют, то необходимо обеспечить пояснение. Для первого разведения/тритурации необходимы следующие детали, или их отсутствие должно быть оправданным:
• метод приготовления;
• описание и характеристики;
• тест на подлинность;
• тест на чистоту;
• определение содержания;
• определение токсичных компонентов.
3.4. Материнская настойка
Материнские настойки для изготовления ГС должны соответствовать фармакопейным статьям и требованиям к качеству, используемым официально, или другим официально признанным документам. Следующие данные нужно представить, или их отсутствие должно быть оправдано:
• метод приготовления (ссылка на общую процедуру);
• вид (внешний) и описание;
• тест на подлинность;
• тест на чистоту;
• процедура испытания на устойчивость;
• определение содержания;
• определение токсичных компонентов;
• процедура для проверки стабильности;
3.5. Конечный продукт
Гомеопатические формы дозировки в конечных продуктах должны отвечать фармакопейным требованиям, и должны быть тестированы для того, чтобы было определено следующее:
• подлинность и содержание (если применимо); в норме тест на единообразие содержания не подходит ни для того, чтобы определить потенцию, ни для демонстрации, что исходный материал или его характерные компоненты нельзя обнаружить;
• качество формы дозировки (единообразие массы, твёрдость и сыпучесть для таблеток – тест на распад можно снять, если обосновано); тест на вязкость или реологию (для мазей);
• остаточные растворители, реагенты или случаиное загрязнение в результате процесса производства (например, Европейская фармакопея 6.0 (22), «резидуальные растворители; ограниченные уровни остаточного растворителя в активных субстанциях, наполнителях и лечебных продуктах»;
• стабильность; тест на стабильность для формы дозировки должен быть минимальным требованием.
3.6. Растворители и эксципиенты
В дополнение к оценке активных субстанций, оценка безопасности должна также включать наполнители и растворители, используемые в ГС. Изготовитель должен обеспечить, чтобы:
• все наполнители и растворители, включённые в конечный продукт, были зарегистрированы в документации и, если применимо, на этикетке, если требует национальное законодательство;
• наполнители и растворители отвечали требованиям фармакопеи, используемой официально, или другого официально признаного документа;
• если включены новые наполнители и растворители, то должны быть даны достаточные данные об их безопасности и качестве национальным Министерством Здравохранения. В зависимости от фармакологической и токсикологической природы наполнителя и растворителей, оценка степени риска должна учесть их общую экспозицию, потому что любое вещество может быть потенциально токсичным после длительного или интенсивного использования. В этом смысле, нужно признавать, что дополнительные источники или пути назначения наполнителя или растворителя из еды или сопутствующего лечения можно добавить к общей ежедневной экспозиции.
Особое внимание нужно обращать на общие обозначения и предупреждения на упаковке конечного продукта. Например, этанол, глицерин и лактоза, часто используемые в изготовлении ГС, зарегистрированы в EU директивой ENTR/F2/BL D (2003), озаглавленной «Эксципиенты на этикетках и аннотациях в пакетах лечебных продуктов для использования человеком» (30), с обозначением порога для индивидуального вещества, основываясь «на дозу».
Управление контроля продуктов питания и лекарств США (US FDA) установило «максимальные пределы концентрации для спирта как неактивного ингредиента в лекарственных продуктах, безрецетурного отпуска (OTC), предназначенных для орального применения». Однако, нужно признать, что «доза» должна быть определена точнее, как единоразовая доза, так и максимальная суточная доза. Важен именно фактический приём наполнителя или растворителя, хотя его количество очень низкое в случае гомеопатических продуктов (а не его процент в конечном продукте). С другой стороны, в гомеопатии малые количества можно использовать несколько раз в день, и такие ГС могут содержать высокие уровни этанола. В этом смысле адекватная достоверная информация, включающая предупреждения, противопоказания и соответствие фармакопейным статьям обязательна, если средства прописаны детям, беременным или кормящим грудью женщинам, или пациентам с историями болезни, включающими печёночную недостаточность, ушиб мозга, припадки или алкоголизм. Другие предупреждения, например, в отношении сахаров, также применимы к ГС.
3.7. Примеси и загрязняющие вещества
На качество и безопасность ГС могут также влиять примеси и случайные компоненты, которые можно найти в конечном продукте как побочный продукт изготовления и хранения, загрязнения или низкого качества сырья, или они могут образоваться во время производственного процесса. Такие компоненты включают микробные токсины, микроорганизмы, металлы, остатки пестицида или продукты деструкции. Эти примеси могут представлять потенциальный риск для пациентов, поэтому должны быть сведены к минимуму. Следовательно, изготовитель/спонсор должны унифицировать и конролировать производство, обработку и хранение. В связи со многими потенциальными примесями и загрязняющими элементами, изменяющими объём поражения и действия со временем, невозможно представить весь список всех примесей, и их предельное количество. Но изготовитель обязательно должен отслеживать их и уменьшать присутствие примесей и загрязняющих элементов. Следующие вопросы необходимо рассмотреть в требованиях относительно примесей и случайных компонентов:
• какие специфические примеси и загрязняющие элементы нужно рассматривать?
• какие тесты (утверждённые и возпроизводимые, на предельное количество, отвечающие официально используемой Фармакопее или другим официально признанным документом), нужно применять?
• какие ограничения должны быть определены? (Если возможно, должны быть использованы фармакопейные ссылки, другое должно быть оправдано).
Поэтому контроль качества должен определять ограничения важных загрязняющих элементов в исходном материале, а также в основных растворе или растирании. Этот аспект особо важен в виду того, что хранение и изготовление могут иметь дополнительные риски случайного загрязнения конечного продукта. В принципе, правовые стандарты и ограничения для конечного продукта должны соответствовать официально используемой Фармакопее или др. официально признанным документам.
Для того, чтобы обеспечить соответствующее качество и безопасностность конечного гомеопатического продукта, тесты на предельное количество продукта, правовые проверки и контроль за производственным процессом являются необходимыми подходами, и применимы к исходным материалам, запасам или материнским настойкам, сырью и наполнителям. Методы, методики и приборы, обязательные для проверки качества ГС, должны соответствовать официально используемой Фармакопее или другим, официально признанными документами.
4. Правила, регулирующие гомеопатические средства
Регламентирующие рамки и их требования к ГС отличны в разных странах. ГС могут подлежать такому же регулирующему контролю, какой применимым к обычным фармацевтическим продуктам, с адаптацией к определённым требованиям для ГС. В некоторых странах они подлежат отдельным регламентирующим рамкам.
Ряд контролирующих органов уже требуют обеспечения качества ГС. Изготовители, упаковщики, машины для этикеток, импортёры и распространители готовых ГС или сырья должны отвечать определённым требованиям, включая эффективный контроль над процессом производства, утверждённые аналитические методы, подходящие здания, надлежащие условия хранения и санитарии.
4.1. Правила изготовления и маркетинг
Исходя из регламентирующих рамок, следует ожидать, что Министерства здравохранения потребуют дорыночного доказательства качества и безопасности. Обычно производители ГС готовят документацию, описывая обеспечение качества вообще, и контроль качества определённых ГС. Сырьё или исходные материалы, материнские настойки, растворители или наполнители и конечные продукты, - все должны соответствовать стандартам качества, опубликованным в официальной Фармакопее или документах соответствующего статуса, и процесс изготовления должен соответствовать применимым принципам GMP (12). Хотя директивы GMP обеспечивают общее руководство для лекарств, включая ГС, они не обязательно имеют особые требования к ГС, например, к процессу утверждения или оценки качества исходного сырья. Теоретически, это может вести к нестандартному качеству продукции, что представляет риск для здравоохранения, и может привести к отзыву продукта. Определённые документы устанавливают базовые принципы в обеспечении контроля качества, учитывая уникальные параметры ГС (4,6,10-12,31-38). Это основные справочники-руководства, которые могут быть приспособлены для индивидуальных потребностей. Однако, рвнозначность альтернативных подходов к обеспечению качества должна быть утвержена.
Проверка процесса производства очень важна, с учётом специфической природы ГС. Полагается она, в большей степени, на соответствие мастер-формуле, обеспечивающей важную информацию о шкале потенциирования, которую нужно принять (например, децимальная, по Ганеману), и подходящим фармакопейным методам; обработке сырья (например, мацерация или перколяция); количеству встряхиваний во время каждого шага потенциирования; продолжительности тритурации; методу насыщения; контролю во время производства; и процедурам, которые нужно соблюдать для получения конечного продукта. («Первый безопасный препарат или разведение» следует чётко обозначить; в зависимости от национальных условий и законодательства, изготовители или распространители ГС могут столкнуться с ограничениями на распространение потенций ниже «первой безопасной». Первый безопасный препарат должен быть определён на основании разборов случаев, и может быть обозначен на любой стадии процесса производства, вплоть до последнего удаления/инактивационных мер в процессе).
4.2. Информация для потребителя
Учитывая состояния, при которых используют ГС, информация для потребителя является очень важным вопросом (39). Особое значение имеет этикетка продукта и аннотация в пакете, которые представляют первую и, во многих случаях, единственную информацию для потребителя, играя ключевую роль в безопасном и рациональном использовании средства. Следовательно, важно, чтобы этикетки давали потребителю необходимую информацию о продукте. Требования к этикеткам отличны в разных странах, и могут быть очень детальны, как, например, в Канаде (Приложение 4).
Список требований к этикеткам дан в Таблице 3 как ориентир, что считать полезным и жизненным. Местные системы государственной регуляци могут требовать дополнительные данные, такие как списки противопоказаний, меры предосторожности и побочные эффекты; а также указания специальных групп больных, таких как беременные или кормящие грудью женщины, дети и люди с аллергиями. Более того, может быть требование, чтобы лицензированное ГС продавали с аннотацией в пакете, подобно обычным средствам. Какая-то информация из вышеуказанной должна быть во вкладыше в пакете, или на вторичной упаковке, согласно национальным условиям.
4.3. Регламентирующие рамки
Задачи, объёмы и подходы национальных регламентирующих рамок для ГС значительно изменяются в разных странах. Даже в очень хорошо отрегулированных системах здравоохранения, упорядочение ГСв может всё ещё пребывает в ранней стадии. Приложение 5 даёт ряд примеров из стран с системой государственного регулирования. Большинство ГС делят на два или более классов - с ограничениями в способе назначения и минимального разведения, а также с упрощёнными процедурами разрешения для тех, которые считают безвредными, используя для ограниченных состояний и продавая без рецепта. В целом, однако, всё ещё есть недостатки информации о проблемах безопасности, и улучшена ли безопасность в тех регионах, где есть режимы регуляции и контроля качества. Есть потребность и в улучшении документации, указании на существование фактических, а не потенциальных проблем безопасности. Например, в ряде стран есть регламентирующие рамки, которые обязывают держателя лицензии сообщать о возможной неблагоприятной реакции после контроля, включая случаи, связанные с дефектами качества и неверного обозначения на этикетке. Такие системы фармацевтической бдительности дают информацию о неблагоприятных случаях. В настоящее время, однако, глобальные базы данных, документируют крайне мало таких случаев, и не известно, это из-за плохого осведомления или действительно из-за отсутствия таких случаев.
Таблица 3. Типичные требования к обозначениям для безопасного и правильного использования гомеопатических средств
• имя и адрес изготовителя, упаковщика или распространителя (с контактным номером телефона или адресом электронной почты, если подходит);
• номер серии изготовления;
• регистрационний номер (если применимо);
• чистое количество (содержание) продукта в контейнере;
• общепринятое название формы дозировки, традиционное гомеопатическое название, обычно используемое в географическом районе, если применимо;
• спецификация, которая определяет продукт как гомеопатический - например, «гомеопатическое средство» или «гомеопатическое средство для использования человеком»;
• научное название активных субстанций, и/или традиционное гомеопатическое название активной субстанции(й), как дано в признанных и официально используемых Фармакопеях, или других официально признанных документах; степень разведения/потенция; и ссылка на Фармакопею, которая была использована для метода изготовления;
• количество активных субстанций в форме дозировки;
• наполнители, если требует национальная система государственного регулирования;
• указания по использования и требуемая дозировка, если применимо;
• показания, в соответствии с национальной системой государственного регулирования;
• условия хранения;
• предупреждения о спирте или лактозе, если применимо;
• предупреждение, которое советует потребителю консультацию с врачом или квалифицированным профессионалом, если симптомы продолжаются или ухудшаются;
• путь назначения;
• срок годности (если требует национальная система государственного регулирования).
Создание регламентирующих правил, приспособленных к специфическим ситуациям, - это обязанность правительств. Однако, они могут и должны использовать преимущества накопленного в мире опыта. Национальные министерства здравоохранения, разработавшие рамки регламентации, могут захотеть приспособить директивы ВОЗ по контролю безопасности растительных средств в системах фармацевтической бдительности (40) для своих правил и систем фармацевтической бдительности. Они могут также захотеть обеспечить более систематический обмен опытом в осуществлении эффективной регуляции. Этот документ предусматривает скромный вклад в такой обмен опытом.
1. Proceedings of the 10th International Conference of Drug Regulatory Authorities (ICDRA), Hong Kong, China, 24-27 June 2002.
2. Pharmacopee Francaise [French Pharmacopoeia]. Vol. 3, 10th Ed. Refondue + Mise A Jour 2003 + Liste Des Plantes Medicinale, Agence Medicame, 2003.
3. German Homeopathic Pharmacopoeia (GHP) Vols 1&2. Stutgart, Medpharm Scientific Publishers, 2006.
4. Homoeopathic Pharmacopoeia of the United States. Southeastern. PA, (HPUS) Homeopathic Pharmacopoeia of the USA (www.hpus.com)
5. Homoeopathic Pharmacopoeia of India. Delhi. Controller of Publications. 1st ed. Vol. 1, 1970; 2nd ed. Vol. 2, 1984; 1st ed. Vol. 3, 1978; 1st ed. Vol. 4, 1984; Vol. 5, 1985; Vol. 6, 1991; Vol. 7, 2000; Vol. 8, 2001.
6. WHO guidelines on GMP for herbal medicines. – WHO, Geneva, 2007.
7. Quality control methods for medicinal plant materials. – Geneva: WHO, 1998.
8. General guidelines for methodologies on research and evaluation of traditional medicine. Geneva, WHO, 2000.
9. Basic tests for drugs – Pharmaceutical substances, medicinal plant materials and dosage forms. Geneva: WHO, 1998.
10. WHO guidelines on GACP for medicinal plants. – WHO, Geneva, 2003.
11. WHO guidelines on assessing quality of herbal medicines with reference to contaminants and residues. – WHO, Geneva, 2007.
12. Quality assurance of pharmaceuticals. A compendium of guidelines and related materials. Vol. 2. GMP and inspection. 2nd updated ed. – WHO, Geneva, 2007.
13. Health Products and Food Branch Inapectorate Guide, supplementary guidelines for homeopathic preparations. Ottawa, Health Canada, 1996.
14. EU Guidelines in GMP, medicinal products for human and veterinary use. Vol. 4, Part II. Brussels, European Comission, 2005.
15. Homeopathic GMP. Southeastern. PA, Homeopathic Pharmacopoeia Convention of the United States, 2007.
16. Guideline of quality of herbal medicinal products/tradicional herbal medicinal products. London. European Mdicines Evaluation Agency, 2006.
17. Annex 7. Manufacture of herbal medicinal products. In: EU Guidelines for GMP, medicinal products for human and veterinary use. Part II – Basic requirements for active substances used as starting materials, vol. 4. Brussels, European Commission, 2005.
18. Australian regulatory guidelines for complementary medicines. Part III. Evaluation of complementary medicine substances. Woden, ACT, Australian Government. Department of Health and Ageing, Therapeutic Goods Administration, 2005.
19. WHO guidelines for TSE in relation to biological and pharmaceutical products. Geneva, WHO, 2003 (WHO/BCT/QSD/03.01).
20. EC recommendations on the conditionsrelated to the “BSE negligible risk (closed) bovine herds”, adopted by SCC 22/23 July 1999.
21. European Pharmacopoeia. Minimizing the risk of transmitting animal TSE agents via human and animal medicinal products and Homeopathy preparations.
22. Council of Europe. European Pharmacopoeia, 6th ed. Strasbourg, Directorate for the Quality of Medicines of the Council of Europe, 2006.
23. EU Directive 2002/98/EC of the European Parliament and the Council of 27.1.2003 setteng standsrds of quality and safety for the collection, testing, processing, storage and distribution of human blood and blood components and amending Directive 2001/83/EC. Official Journal of the European Union, L33/30.
24. Annex 14. Manufacture of medicinal products derived from human blood or human plasma. In: In: EU Guidelines for GMP, medicinal products for human and veterinary use. Part II – Basic requirements for active substances used as starting materials, vol. 4. Brussels, European Commission, 2005.
25. Homeopathic Preparations. In: European Pharmacopoeia, 6th ed. Strasbourg, Directorate for the Quality of Medicines of the Council of Europe, 2007.
26. Harmonized tripartite guideline, derivation and characterization of substrates used for production of biotechnological products (Q5D). Internatonal Conference on Harmonisation, 1997.
27. Harmonized tripartite guideline, derivation viral safety evaluation of biotechnological products derived from cell lines of human or animal origin (Q5AR1). Internatonal Conference on Harmonisation, 1999.
28. Directive 2001/18/EC of the European Parliament and ofthe Council on the deliberate release into the environment of genetically modified organisms and repeating Council Directive 90/220/EEC. Official Journal, L106 of 17.4.2001.
29. Directive 90/219/EEC on the contained use of genetically modified micro-organisms. Official Journal, L117 of 8.5.1990:1.
30. European Medicines Agency. Excipients in the label and packadge leaflet of medicinal products for human use. London, European Medicines Agency, 2003 (ENTR/F2/BL В (2003)).
31. European Comission Directive 2001/83/EC of the European Parliament and the Council on the Community code relating to medicinal products for human use (2001) amended by Directive 2004/27/EC of the European Parliament and the Council. Chapter 2. Specific provisions applicable to homeopathic medicinal products. Official Journal, L136, 30/4/2004:34-57.
32. 21 Code of Federal Regulations Parts 210&211: Current GMP in manufacturing, processing, packing or holding of drugs: general and current GMP for finished pharmaceuticals. Rockville, MD, US FDA, 2006.
33. Australian regulatory guidelines for complementary medicines. Part III. Evaluation of complementary medicine substances. Australian Government. Department of Health and Ageing, Therapeutic Goods Administration, Symonston, ACT, 2005.
34. GMP guidance document. Ottawa, Health Canada. NPHD, 2003.
35. Directive 2003/94/EC of the European Parliament and the Council. Principles and guidelines of GMP in respect of medicinal products for human use and investigational products for human use. Official Journal I.262, 14/10/2003/: 22-26.
36. Directive 2004/27/EC of the European Parliament and the Council of 31 March 2004 amending Directive 2001/83/EC от the Community code relating to medicinal products for human use (2004).
37. Harmonized tripartite guideline, validation of analytical procedures: text and methodology (Q2R1). Internatonal Conference on Harmonisation, 2005.
38. GSR 678 (E). Ministry of Health and family Welfare notification – GMP and requirements of premices, plant and equipments for homoeopathy. New Delhi, Ministry of Health and Family Welfare, 31.10.2006.
39. Guidelines for development of consumer information for proper use of traditional medicine and complementary/ alternative medicine. Geneva, WHO, 2004.
40. WHO guidelines on safety monitoring of herbal medicines in pharmacovigilance systems. Geneva, WHO, 2004.
В Консультативном Совете работали 21 специалист по гомеопатической фармации и гомеопатии (Австралия, Бразилия, Великобритания, Венгрия, Германия, Индия, Италия, Канада, Куба, Малайзия, Мексика, Непал, Нидерланды, Пакистан, США), а также трое представителей ВОЗ, под руководством д-ра Xiaorui Zhang, координатор по традиционной медицине ВОЗ.
Терминологию из этого документа обычно применяют в гомеопатическом сообществе, хотя и непоследовательно. Для целей этого документа участники консультаций ВОЗ по качеству ГС, которые проведены в Милане (Италия, 2007), пришли к консенсусу в определениях, используемых повсеместно в этом документе. Определения в этом словаре не претендуют быть абсолютными, ноа дают необходимую последовательность для единого и точного упорядочивания ГС.
Активное вещество (Active substance): Считают, что активные вещества являются исходными материалами, обрабатываемыми одной или рядом процедур для изготовления ГС, зарегистрированных в официально используемых Фармакопеях и других официально признанных документах (например, материнские настойки, разведения или тритурации).
Загрязнение/заражение (Contamination) (1): Нежелательное введение примесей химической или микробиологической природы, или инородного вещества, или другого ГС, в первоначальный материал, или промежуточный продукт, или конечные ГС во время производства, тестирования, упаковки или повторной упаковки, хранения или транспортировки.
Перекрестное загрязнение/заражение (Cross-contamination) (1): Загрязнение первоначального материала, промежуточного продукта или конечного продукта другим первоначальным материалом или продуктом во время производства.
Растворитель (Diluent): Вещество, используемое для подготовки сырья/первоначального материала или процесса потенцирования; может также представлять вещество в дозированной форме. Жидкие растворители обычно состоят из очищенной воды, водного раствора, глицерина или этанола соответствующей концентрации, для которых есть соотвествующая статья. Самый распространённый твёрдый растворитель – это обычно моногидрат лактозы.
Разведение (Dilution): Разведение имеет 2 смысла в гомеопатии:
• Для продукта, разведением будет жидкий гомеопатический препарат, который потенциируют, как описано ниже (см. определение потенциирования). Индивидуальные разведения также называют потенциями;
• Как процедура, разведение означает процесс деконцентрации жидкости или твёрдого препарата. Одна часть каждого этапа в приготовлении ГС из сырья или предыдущего разведения (потенции), путём добавления одной части ранее твёрдой или жидкой фазы к определённому весу или объёму растворителя (см. Потенциирование ниже). Разведение на всех этапах изготовления ГС происходит добавлением твёрдого наполнителя в тритурацию, или добавлением растворителя в жидкой фазе и встряхиванием.
Динамизация (Dinamization): см. потенцирование (se potentization)
Форма дозировки (Dosage form): форма дозировки в гомеопатии соответствует всем особенностям для таких доз, чему соотвествует характеристика (описание) в официально используемой Фармакопее или другом официально признаном документе. Наиболее часто используемой гомеопатической формой дозы является globule - крупинка (pillule - пилюля или pellet - шарик) – это твёрдая шарообазная гранула (spherule), состоящая из лактозы, сахарозы или любого другого подходящего носиителя. Обычно преформированнные крупинки пропитаны раствором или сразу материнской настойкой. Форма дозировки ГС в виде tablet - таблетки представляет собой твёрдый препарат, соответствующий описанию таблеток в официально используемой Фармакопее (или в другом официально признанном документе). ГС в форме таблетки готовят путём пропитывания преформированных таблеток, или сжатием тритураций с носителем. Наиболее часто используемые жидкие ГС - спиртовые растворы, или жидкости ля перорального употребления.
Наполнитель (Excipient): Вещество, используемое после потенцирования, и необходимое для изготовления дозировки: пшеничный крахмал и стеарат магния для таблеток. Может также быть веществом дозированной формы.
Инородное вещество (Foreign matter) (2): Эти материалы состоят из любого следующего компонента: части исходного материала или других материалов, не разрешённые к допуску, определённому для рассматриваемого ГС; любой организм, часть или продукт организма, не разрешённые к допуску, определённому и описанному для рассматриваемого ГС.
Гомеопат (Homeopath): Квалифицированный врач, практикующий гомеопатическое лечение.
Гомеопатические средства (Homeopathic medicines): Любое средство, изготовленное в соответствии с гомеопатической процедурой по производству, описанной официально используемой Фармакопеей или другим официально признанным документом. ГС может содержать несколько гомеопатических препаратов. (Отметим, что ряд стран используют термины «гомеопатические средства» или «гомеопатические препараты». Сравним определения в: США: ГС - любое средство, обозначенное как гомеопатическое и зарегистрированное в гомеопатической Фармакопее Соединенных Штатов (HPUS) (3), в приложении к ней или дополнении. Потенции ГС определены понятием разведения: 1х (разведение 1/10), 2x (1/100) и т.д. Гомеопатические лекарственные продукты должны содержать растворители, обычно используемые в гомеопатической фармации. Лекарственные продукты, содержащие гомеопатические ингредиенты в комбинации с не гомеопатическими активными ингредиентами, не будут гомеопатическими лекарственными продуктами. FDA - Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (4). Канада: ГС будут продукты (і), изготовленные только из (или содержащие, как лечебные ингредиенты) веществ, снабжённых ссылками на статьи в одной из следующих гомеопатических Фармакопей, по мере того, как их время от времени корректируют: Гомеопатическая фармакопея Соединенных Штатов (HPUS) (3); Homoopathisches Arzneibuch (HAB) или Немецкая гомеопатическая фармакопея (GUP) (5); Franfaise Pharmacopee или Французская фармакопея (PhF) (6); Европейская фармакопея (Ph.Eur.) (7); Энциклопедия гомеопатической фармакопеи (EHP) (8); и (ii) произведенные в соответствии с методами, указанными в одной из вышеуказанных гомеопатических Фармакопей, по мере их коррекции. Директорат натуральных продуктов здоровья (NHPD) (9): Свидетельство по руководству по ГС (2007). Индия: ГС включают любое средство, полученное в гомеопатических прувингах, или терапевтическая эффективность которого установлена путём длительного клинического опыта, как описано авторитетами в гомеопатической литературе Индии и за рубежом; изготовленное согласно методам гомеопатической фармации, или включает комбинацию ингридиентов таких ГС, но не включает лекарства, назначенные парентрально. Акт о лекарствах и косметике 1940, откорректирован в 2005 (10). Европейский Союз: гомеопатические лечебные продукты - любые лечебые продукты, изготовленные из веществ, названных гомеопатическим сырьём, в соответствии с гомеопатической процедурой производства, описанной Европейской Фармакопеей или, в отсутствии её, Фармакопеями, используемым в настоящее время официально в государстве-члене ЕС. Гомеопатический лечебный продукт может содержать ряд составных частей. Директива 2004/27/EC (коррекция Директивы 2001/83/EC) (11). В Евросоюзе гомеопатические препараты приготовлены из веществ, продуктов или средств, называемых сырьём, в соответствии с гомеопатической процедурой изготовления. ГС обычно обозначают латинским названием сырья, за которым следует указание степени разведения. Европейская фармакопея (7). Швейцария: ГС являются лечебными продуктами, содержащими гомеопатические активные субстанции, изготовленные исключительно в соответствии с фундаментальными принципами гомеопатических процедур, описанных в Фармакопее, в Немецкой гомеопатической Фармакопее («Homoopathischen Arzneibuch» (HAB) (5)), во Французской Фармакопее («Pharmacopee Fragaise (Ph.F.) (6); раздел «гомеопатические препараты») или в Британской гомеопатической фармакопее (B.Hom.P.) (12), и которые используют в соответствии с принципами гомеопатической терапии. Швейцарское агенство по терапевтическим продуктам (13). В Швейцарии гомеопатические однокомпонентные препараты являются гомеопатическими лечебными продуктами с одной гомеопатической активной субстанцией: материнские настойки, растворы, порошки, жидкие или твёрдые гомеопатические разведения. Швейцарское агенство по терапевтическим продуктам (13). Гомаккорды (Homaccords) – это смеси отдельных (с одним веществом) гомеопатических препаратов из одного и того же первоначального материала с разными потенциями. Швейцарское агенство по терапевтическим продуктам (13). Гомеопатические комплексы: смеси, которые содержат исключительно гомеопатические одиночные средства или homaccords. Швейцарское агенство по терапевтическим продуктам (13). Австралия: гомеопатические препараты - это препараты: (a) сделанные для использования по принципу, что он способен производить у здоровых людей симптомы, подобные тем, которые должны быть уменьшены при его назначении; и (b) приготовленные согласно практике гомеопатической фармации, используя методы: (i) серия разведений и встряхиваний от материнской настойки в воде, этаноле, водном этаноле или глицерине; или (ii) серия тритураций в лактозе. Назначение терапевтических товаров (14)).
Гомеопатия (Homeopathy): Классическая гомеопатия - система медицины, использующая изготовление веществ, чей эффект, при назначении здоровым людям, соответствует проявлению нарушений у отдельных пациентов (см. разд. 3.1.1). (Сравним определения в: Индии: система медицины, которая верит в специфический системный метод лечения, путём излечения естественных заболеваний назначением потенциированного препарата, экспериментально проверенного в прувингах, обладающего силой производить подобные искусственные симптомы у здоровых людей. DAYNUSH (15). США: практика лечения синдромов и состояний, образовывающих заболевание, лекарствами, которые вызывают подобные синдромы и состояния у здоровых субъектов. FDA (4)).
Гомеотерапия (Homeotherapy): Справочное название для группы терапевтических подходов, возникших из гомеопатической терапии, установленной С. Ганеманом. Гомеотерапия состоит из: классической гомеопатии; клинической гомеопатии; гомеопатических комбинаций продуктов; антигомотоксической терапии и гомотоксикологии; изопатии; антропософской медицины; биохимической медицины по д-ру Шюсслеру (Schussler); spagyric-терапии; геммотерапии; литотерапии; и резонансной гомеопатии.
Невесомые (энергетические) ГС (Imponderabilia): ГС, изготовленные из энергий, естественных и физических реакций. Они означают «невзвешиваемые», т.е. не имеют никакого уловимого веса. Они могут также быть приготовлены путем действия солнечного света (Sol), энергии магнитных полей (Magnetis Polus Australis), радиации (X-ray) на спирт или воду.
Материнский раствор – Mother solution (также называемый тинктурой - solution): наиболее концентрированный раствор, изготовленный из вещества минерального или химического происхождения путём растворения его в спирте или очищенной воде. Он также может быть приготовлен путем действия источника энергии на спирт или очищенную воду (см. Imponderabilia).
Материнское вещество (Mother substance): см. исходный материал (see source material)
Материнская настойка - Mother tincture (также называемыая настойкой, тинктурой - tincture): Первоначальный гомеопатический препарат, сделанный из исходного материала, который можно в дальнейшем потенциировать (также называемый «жидким сырьём» - «liquid stock»); иногда используют как ГС, считают самой концентрированной формой конечного ГС. Материнские настойки получают классическими методами вымачивания (мацерации) или перколяции - процеживания (иногда также сбраживанием, настоем, отваром или заквашиванием) исходных материалов согласно процедуре, предписываемой признанной гомеопатической Фармакопеей. Иногда материнские настойки (МТ) соответствуют первому десятичному разведению, «1D» или «IX» (10-1), главным образом, когда в качестве исходного используют сухой растительный материал.
Нозоды (Nosodes): ГС, изготовленные из продуктов болезни людей или животных; из патогенных организмов или их продуктов метаболизма; или из продуктов разложения животных органов.
Потенция (Potency): Называемая степень серии тритураций или разведений и встряхиваний, достигаемая для каждого ГС. Степени разведения или потенции обычно указывают буквами D, DH или X для последовательных 1:10 разведений (десятичные разведения), буквами С, CH или К, или CK - для последовательных от 1:100 (cотенных) разведений, а Q (LM) обозначает последовательные от 1:50000 (Ганемановские пятидесятитысячные) разведения. Разведение 1:10 обозначает 1 часть, обрабатываемую с 9 частями растворителя (Ганемановские десятичные), разведение 1:100 - 1 часть, обрабатываемую с 99 частями (Ганемановские или Корсаковские сотенные), и т.д. Номер, предшествующий букве (например, D, C или LM) обычно показывает число используемых шагов разведения (Таблица 1). Как следствие различных взглядов и разных подходов в гомеотерапии, и так как понятие этого термина может зависеть от природы исходных материалов, термины «высокая» и «низкая» потенция нельзя определить точно.
Потенциирование - Potentization (также называют динамизацией - dinamization): Совмещённый процесс серии разведений и встряхиваний, или тритураций на каждом шаге, при изготовлении ГС из сырья (согласно принципу гомеопатии, потенциирование представляет процесс, при котором возникает активность ГС).
Таблица 1. Таблица потенций
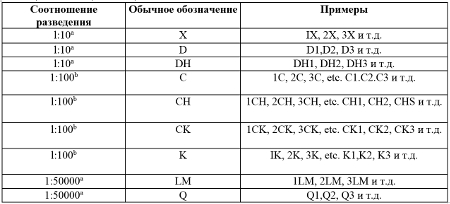 а Для 1:10 и 1:50000 разведений используют только многоскляночный метод изготовления Ганемана.
в Для потенции 1:100 разведения предполагают, что для C потенции используют Ганемановский метод изготовления (многоскляночный), его можно также обозначать CH. Когда используют Корсаковский метод изготовления (метод одной склянки), потенцию обозначается CK или K.
Сырье (Raw material): см. исходный материал (see source material)
Саркоды (Sarcodes): ГС, изготовленные из здоровых животных тканей или секретов. На греческом языке саркод означает «телесный».
Исходный материал – Source material (сырье – raw material, первоначальный материал – starting material, материнское вещество – mother substance): Исходным материалом будет исходное сырьё, используемое для производства ГС. Этот материал получен из естественных источников, например, ботанического, зоологического, микробиологического, минерального, химического, животного и человеческого происхождения, или синтетических процедур. Исходные материалы могут пройти предварительную обработку, обработываться дальше.
Первоначальный материал (Starting material): см. исходный материал (see source material)
Сырьё (Stock): Вещества или препараты, сделанные из исходных материалов (например, вымачиванием, встряхиванием или тритурацией), используемые как отправные точки для производства ГС. (Следует отметить, что этот термин не используют все системы государственного регулирования гомеопатии (он использован во Французской фармакопее (6), Европейской фармакопее (7), и Директиве Евросоюза 2001/83/EC (11), но не другими). Более того, в рядех гомеопатических систем, сырьё служит материнской настойкой или материнским раствором, тогда как, согласно другим, сырьё может также само представлять исходный материал. В Евросоюзе сырьё определено как вещества, продукты или препараты, используемые как первоначальные материалы для продукции гомеопатических препаратов. Сырьё обычно одно из следующего: материнская настойка или размачивание в глицерине, - для сырого материала ботанического, зоологического или человеческого происхождения, или само вещество - для сырого материала химического или минерального происхождения. Европейская фармакопея) (7)).
Встряхивание (Succussion): Процедура энергичных встряхиваний с ударом или эластичным столкновением, выполненная на каждом этапе разведения при изготовлении гомеопатической потенции. В ряде Фармакопей могут быть описаны особые методы для передачи удара в др. областях гомеотерапии.
Тритурация (Trituration): Тритурация имеет два смысла в гомеопатии. Для продукта тритурация имеет в виду твёрдый гомеопатический препарат, который был потенциирован. Как гомеопатическая процедура, тритурация имеет в виду процесс деконцентрации твёрдого материала с другим твёрдым материалом. Это этап в подготовке твёрдой фазы ГС из его сырья, или предыдущая тритурация путём добавления одной части к прописанному количеству частей растворителя (лактозы или другого, как определено в соотвествующей официально используемой Фармакопее, или в др., официально признанных документах.
Разбавитель (Vehicle): См. растворитель (see diluent).
1. WHO guidelines on GMP for herbal medicines. – WHO, 2007.
2. Quality control methods for medicinal plant materials. – Geneva: WHO, 1998.
3. Homoeopathic Pharmacopoeia of the United States. Southeastern. PA, (HPUS) Homeopathic Pharmacopoeia of the USA (www.hpus.com).
4. U.S. Food and Drug Administration. Compliance Policy Guide (CPC 7132.15) Conditions Under Which Homeopathic Drugs May be Marketed. Revised March 1995.
5. German Homeopathic Pharmacopoeia (GHP) Vols 1&2. Stutgart, Medpharm Scientific Publishers, 2006.
6. Pharmacopee Francaise [French Pharmacopoeia]. Vol. 3, 10th Ed. Refondue + Mise A Jour 2003 + Liste Des Plantes Medicinale, Agence Medicame, 2003.
7. Council of Europe. European Pharmacopoeia, 6th ed. Strasbourg. Directorate for the Quality of Medicines of the Council of Europe, 2006.
8. Varma, PN. Vaid I. Encyclopedia of homeopathic pharmacopoeia, 4 vols. New Delhi, Jain, 2007.
9. Natural Health Products Directorate (NHPD). Evidence for homeopathic medicines guidance document (2007).
10. (India) Drug and Cosmetics Act 1940, as amended 2005.
11. European Commission Directive 2001/83/EC of the European Parliament and the Council on the Community code relating to medicinal products for human use (2001), amended by Directive 2004/27/ec of the European Parliament and the Council. Chapter 2. Specific provisions applicable to homeopathic medicinal products. Official Journal I.136, 30/4/2004/: 34-57.
12. British homeopathic Pharmacopoeia. London. British Homoeopathic Society, 1876.
13. Swiss Agency for Therapeutic Products. Ordinanceof the Swiss Agency for Therapeutic Products on the simplified authorization of complementary and herbal medicinal products (KPAV, 2006).
14. Therapeutic Goods Administration. TGA. Therapeutic Goods Regulations 1990, Statutory Rules 1990 No. 394 as amended.
15. Department of Ayurveda, Yoga & Naturopathy, Unani, Siddha and Homeopathy, Annual Report 2000-2001. Chapter 2. Ministry of Health & Family Welfare, Government of India.
(Выдержка из документа Руководителей лекарственных агенств - Рабочей группы по гомеопатическим лечебным продуктам (Руководители лекарственных агенств – это сеть из компетентных специалистов - руководителей национальных организаций, ответственных за регулирование лечебных продуктов для использования человеком и в ветеринарии, в Европейском экономическом пространстве).
Рабочая Группа по гомеопатическим лечебным продуктам (HMPWG) и пункты по безопасности ГС биологического происхождения, которые нужно рассмотреть.
Обсуждение в HMPWG Январь 2001 - Апрель 2005
Сообщение для консультации Март 2005
Обсуждение в HMPWG Декабрь 2005
Принятие для передачи в HMA Март 2007
ПЛАН
1. Введение
2. Объём
3. Препараты, задействованные в процессе производства
4. Исходный биологический материал, используемый для производства гомеопатических лечебных продуктов (ГЛП)
4.1. Поиск биологических материалов
4.1.1. Животного происхождения
4.1.1.1 Вирусное загрязнение
4.1.1.2 Передача TSE
4.1.2. Лечебные продукты
4.1.3. Человеческого происхождения
4.1.4. Продукты, полученные изчеловеческих, животных и микробных колоний клеток
4.1.5. Продукты, полученные из вирусных препаратов
4.1.6. Генетически модифицированные организмы
5. Процесс производства и безопасность гомеопатических лечебных продуктов и первых безопасных препаратов
5.2. Изготовление гомеопатических лечебных продуктов и первых безопасных препаратов
5.3. Человеческого происхождения
5.4. Передача TSE
5.5. Продукты, полученные из биотехнологий
6. Оценка риска гомеопатических лечебных продуктов биологического происхождения (ГЛПБП)
Введение
Гомеопатические лечебные продукты биологического происхождения разнообразны в природе. Препараты включают материалы из видов широкого диапазона, от людей до бактериальных и вирусных веществ, как из здоровых, так и патологических источников. Большой спектр веществ подразумевает, что качество и безопасность гомеопатических лечебных продуктов должны быть рассмотрены на основании проверки, учитывая индивидуальный характер каждого продукта и его намеченное использование. Этот документ даёт требования, которым должны отвечать, по зарегистрированной процедуре, ГЛПБП. Вообще, ГЛПБП должны гарантировать такие же качество и безопасность, как и другие лечебные продукты. Особые меры предосторожности должны быть предприняты к нозодам, из-за их внутренней патологической природы и происхождения.
Биологические материалы, из-за их сложной природы, требуют дополнительных мер предосторожности к качеству и безопасности изготовления. Согласно ткани/виду, из которого их взяли, особое внимание нужно обращать на микробиологическую и вирусную безопасность, передачу губковидной энцефалопатии (TSE) или отрицательные влияния, вызванные добавками/наполнителями. Поэтому ГЛП должны продемонстрировать, среди прочего, детализацию качества для исходных материалов и первых безопасных препаратов, а также контроль качества в процессе изготовления.
В зависимости от природы биологического начального материала, исследования по безопасности по отношению к риску передачи инфекции должны быть выполнены у первого безопасного препарата или, если возможно, на уровне сырья. Что касается вирусной безопасности, должны быть выполнены исследования по вирусному контролю. Оценку риска, что касается вирусной безопасности, необходимо выполнить для ГЛП, содержащих материалы биологического происхождения. Оценка риска должна рассматривать все факторы, которые могут влиять на потенциальный уровень заразных частиц в ГЛП, и потенциальный риск для пациента, исходя из его намеченного использования.
Этот документ даёт руководство по минимальным требованиям, чтобы обеспечить качество и безопасность биологических материалов, используемых в ГЛП, учитывая их биологическое происхождения и ступени изготовления, задействованные до первого безопасного препарата.
2. Объём
Эта директива применима только к ГЛП для перорального и внешнего применения, как указано в ст. 14 Директивы 2001/83/EC, откорректированной Директивой 2003/63/EC, или в ст. 17 Директивы 2001/82/EC. Для парентральных форм качество и безопасность должны быть продемонстрированы согласно ст. 16 или 19 этих же директив, соответственно. Однако, меры безопасности должны иметь эквивалентную силу для парентральных форм, имея в виду, что их намеченное использование может включать применение при повреждениях кожи и слизистой.
Исходные материалы биологического происхождения могут быть получены из:
• людей, например колоний человеческих клеток, здоровых тканей или жидкостей, или нозодов, таких как человеческие повреждения/инфицированные материалы;
• животных, например, все органы животных, ткани, животные секреты, токсины, здоровые или больные ткани и вытяжки (нозоды), продукты крови, паразиты, колонии животных клеток;
• микроорганизмов (например, бактерии, вирусы, микроскопические грибки, паразиты растений);
• растений, например, части растений, секреты растений, вытяжки, материнские настойки, пыльца, колонии клеток растения, макроскопические грибки.
Растительные материалы вне объёма этого руководства. Качество, необходимое для таких продуктов, определено в другом тексте. Относительно грибков - рассматривают лишь макроскопические грибки растительного происхождения, - поэтому не входят в данный документ; микроскопические грибки следует рассматривать совместно с микроскопическими организмами, отвечая этому документу.
3. Препараты, задействованные в процессе производства
В контексте данного руководства, используемые термины были взяты из Директивы 2004/27/CE и Европейской Фармакопеи. Для пояснения процессов производства, в пределах их собственной изменчивости, необходимо включить:
1) Человеческий и животный виды и микроорганизмы, как исходные материалы.
2) Первоначальные материалы, соответствующие гомогенным препаратам тканей/клеток или вытяжек, без дальнейшей обработки.
3) Гомеопатическое сырьё, полученное по стадиям изготовления, которое может включать вымачивание, ферментационные обработки, разведения, извлечения или любые другие средства достижения основного объёма, из которого будут изготовлены гомеопатические разведения.
4) Первый безопасный препарат, как часть, полученная на любом уровне процесса производства до последнего шага удаления/инактивирования. Первый безопасный препарат должен отвечать принципам минимизации риска передачи патогенного вещества.
5) Нозоды, находящиеся в гомеопатических препаратах, сделанных из продуктов человеческих или животных болезненных процессов, из патогенов или их метаболических продуктов, из продуктов разложения животных органов, или из микроорганизмов, выращиванных в питательной среде.
4. Биологический исходный материал, используемый для производства ГЛП
4.1. Источник биологических исходных материалов
4.1.1 Животного происхождения
При заборе животных материалов для производства, должны быть приняты меры безопасности во избежание передачи патогенных веществ людям и/или животным. Исходные материалы животного происхождения должны отвечать принципам минимизации риска передачи патогенных веществ, учитывая характеристики вида относительно скрытых заразных веществ, не предпологаемых гомеопатическим лечебным веществом. Возможную видовую инфективность нужно учитывать в контрольных вирусных анализах, для выбора подходящих или, если нужно, модельных вирусов; это и будет частью оценки риска. Под таким принципом, источник животного вида должен отвечать руководству OIE для того, чтобы гарантировать санитарную безопасность мировой торговли животными и животноводческими продуктами. Когда применимо, должны быть рассмотрены тексты Европейской Фармакопеи, и чётко определённые квалификационные процедуры. Должны быть соблюдены общие принципы, представленные ниже в этом руководстве. Если используют альтернативные процедуры, то необходимо объяснение.
Производитель сырья или ГЛП должен обеспечить, чтобы животные материалы брали из задокументированных и зарегистрированных источников, и должен регулярно выполнять проверку поставщиков. Поставщик животных должен подлежать регулярному законному наблюдению компетентных ветеринарных служб. Любое исключение из этого должно быть оправдано.
Здоровые животные должен быть использованы для производства гомеопатических лечебных продуктов. Если возможно, животных-доноров следует содержать в закрытых табунах, для разведения и производства. Насколько возможно, следует избегать диких животных. Животные должны содержаться в группах, и быть изолированы от контакта с другими животными всё время в период перехода или использования. Линии, происхождение и, если возможно, число животных, должны быть определены. Если используют больных животных (для нозодов), характеристики патологического состояния и инфективность должны быть чётко определены. Если болезнь индуцирована в животном, то природа, источник и штамм (если уместно) используемого вещества/агента должны быть задокументированы.
Когда используют животных высших видов, должен проходить регулярный мониторинг здоровья, чтобы убедиться, что животные проходят непрерывный и систематический ветеринарный и лабораторный контроль для того, чтобы обеспечить отсутствие заразных веществ. Это должно включать постоянный контроль ветеринара за табуном животных, регулярный патологический осмотр случайно выбранных животных, серологические анализы на ряд вирусов, бактерий и паразитов, и осмотр состояния здоровья. Результаты контроля за здоровьем животного должны быть задокументированы.
Производитель ГЛП должен гарантировать, что будет немедленно сообщать в компетентные органы о недавно появившихся серьёзных ветеринарных заболеваниях у поставляемого вида животных.
4.1.1.1 Вирусное и микробиологическое загрязнение
Особое внимание следует уделять возможному вирусному и микробиологическому загрязнению, и должны быть выполнены тесты на значимые вирусы. Микробиологическое качество должно соответствовать Европейской Фармакопее. Вообще, вирусное состояние вида, отобранного для производства, должно быть правильно охарактеризовано, учитывая намеченное использование. Для тех видов, которые далеки от человека и/или животного, с неизвестным риском ношения человеческих и/или животных патогенов, другие факторы должны учитываться, а именно, возможность прямой или косвенной передачи заболевания.
4.1.1.2 Передача TSE
Особо, при оценке риска передачи TSE, сырыми и исходными материалами, наполнителями, а также реагентами, участвующими в процессе производства, а именно бычьего, овечьего и козьего происхождения, и всеми другими видами, восприимчивыми к TSE, должны выполняться Директивы: 2001/83/EC, откорректированная Директивой 2003/63/EC, или 2001/82/EC; выполняя требования, указанные в примечании к руководству «Снижение риска передачи животной TSE через человеческие и зооветеринарные лечебные продукты», и его дополнениях, как определено для лечебных продуктов.
Когда используют части животных, подходящих для потребления человеком, достаточно ветеринарного сертификата для того, чтобы продемонстрировать соответствие первоначального материала, используемого для ГЛП, учитывая ограничения для перорального и внешнего использования.
4.1.2 Лечебные продукты
В настоящее время исходные материалы, используемые в качестве лечебных продуктов, такие как сыворотки, вакцины, токсины и т.д., должны иметь то же качество, что и утверждённые лечебные продукты, и соответствовать CPMP/BWP/3354/99 «Примечанию к руководству по производству и проверке качества животных иммуноглобулинов и иммунных сывороток для использования человеком».
4.1.3 Человеческого происхождения
При использовании исходных материалов человеческого происхождения в производстве ГЛП для использования человеком, должна быть исследована проблема передачи дополнительных веществ (вирусных и невирусных), начиная с уровня выбора донора и по отношению к задействованной ткани. Верные критерии для выбора донора должны быть чётко определены. Требования к донорам ткани должны соблюдать требования Директивы 2004/23/EC Европейского парламента и Совета от 31.03.2004 г., и Директивы 2004/23/EC 2004.
Человеческий материал может содержать кровь, или может быть подвергнут её действию во время процесса извлечения, поэтому передача вирусов особенно беспокоит; по этой причине выбор доноров должен соблюдать директивы Комиссии 2004/33/EC от 22.03.2004 г. «Выполнение директивы 2002/98/EC Европейского парламента и Совета в отношении некоторых технических требований для крови и компонентов крови», и другие директивы Комиссии по выполнению директив 2002/98/EC.
Следует исследовать перекрестную инфективность видов, если продукт используют в разных видах.
4.1.4 Продукты, полученные из человеческих, животных и микробных колоний клеток
Колонии человеческих, животных и микробных клеток, используемые для производства или как сырьё, должны отвечать рекомендациям, предусмотренным Руководством CPMP/ICH/294/95 «Источник и описание субстратов клеток, используемых для производства биотехнологических/биологических продуктов», или «Руководства для производства и контроля за иммунологическими ветеринарными лечебными продуктами», том 7B Eudralex, CPMP/BWP/1793/02 «Примечания к руководству по использованию бычьей сыворотки при изготовлении человеческих биологических лечебных продуктов» и CVMP/743/00 «Примечания к руководству по требованиям и контролю, применяемые к бычьей сыворотке (фетальной или телёнка), используемой в производстве иммунологических ветеринарных продуктов». Кроме того, колонии клеток человека и животных, как первоначальный материал, должны быть подготовлены согласно установленных рекомендаций для аллогенетических и ксеногенетических клеточных терапевтических продуктов в CPMP/BWP/41450/98 «Пункты для рассмотрения при производстве и проверке качества человеческих соматических клеточных терапевтических лекарственных продуктов» и CPMP/BWP/3326/99 «Концептуальная статья о развитии на CPMP пунктов, которые нужно рассматривать при терапии ксеногенетическими клетками».
4.1.5 Продукты, полученные из вирусных препаратов
Когда ГЛП получен из вирусного препарата, должна быть уверенность, что вирус эффективно деактивирован во время процесса производства, и соотвествующий контроль процесса инактивации должен быть выполнен.
4.1.6. Генетически модифицированные организмы
Использование генетически модифицированных организмов как первоначального материал адолжно пребывать в соответствии с директивами 2001/18/EC и 90/219/EEC (откорректированной).
5. Процесс производства и безопасность ГЛП и первого безопасного препарата
5.1. Первый безопасный препарат
Первый безопасный препарат должен быть определён на основании контроля случаев. Первый безопасный препарат можно определить на любом уровне процесса производства, вплоть до последнего шага удаления/инактивации, введенного в процесс. Только первые безопасные препараты могут быть использованы для того, чтобы изготовить ГЛП, отвечающие принципам минимизации риска передачи патогенного вещества, учитывая потенциал инфекции вида, за исключением гомеопатического терапевтического вещества. Для изготавления ГЛП, полученных из человеческого и/или животного материала, как патогенного, так и здорового, необходимо подходящее определение, что нужно рассматривать как первый безопасный препарат для каждого сырья. Это определение обеспечивает правильно определение вирусных исследований для того, чтобы их применить для оценки предполагаемой инфективности. Исследования безопасности, учитывая вирусные и невирусные случайные вещества, должны быть выполнены на этом самом низком уровне, до производства дальнейших разведений и/или других гомеопатических препаратов.
5.2 Изготовление гомеопатического лечебного продукта и первых безопасных препаратов
Только разведения сами по себе не обеспечивают биологическую безопасность первого безопасного препарата. Этапы производства на уровне гомеопатических разведений, таких как растворитель/очиститель, фильтрация или пастеризация, могут способствовать безопасности первого безопасного препарата. Первые безопасные препараты должны быть правильно охарактеризованы, оперируя понятиями микробиологической, вирусной и TSE-безопасности. Контрольные анализы на вирусы должны быть выполнены при производстве первого безопасного препарата. Эффективность процесса производства для того, чтобы деактивировать или извлечь случайные вещества, важна для биологической безопасности первого безопасного препарата ГЛП. Должны быть предприняты соответствующие измерения для снижения риска инфекционных агентов в гомеопатических препаратах - они должны соответствовать требованиям Европейской Фармакопеи к гомеопатическим препаратам. Контроль за процессом инактивации/удаления вирусов должен быть проведен в специально созданных исследованиях на вирусы на модели вирусов, выполненных согласно Руководству CPMP/BWP/268/95 «Создание, вклад и интерпретация исследований по инактивации и удалению вирусов».
5.3. Человеческого происхождения
Первоначальные материалы человеческого происхождения должны считать потенциально заразными. Когда используют человеческие ткани или экскреты, производство должно включать обоснованные шаги для уменьшения/исключения загрязнения первоначального материала, ещё и для того, чтобы максимально исключить предполагаемые патогенные агенты, которые могут присутствовать. Производство ГЛП человеческого происхождения должно отвечать разделу CPMP/BWP/269/95 Rev. 3 «Примечания к руководству по лечебным продуктам, полученным из плазмы», с необходимыми оправданными переделками согласно задействованному материалу и предназначенному использованию.
5.4 Передача TSE
Первоначальный материал и другие вещества, участвующие в процессе производства, такие как реагенты, полученные из тканей бычьего, козьего и овечьего видов, а также других видов, восприимчивых к TSE, должны отвечать принципам уменьшения риска передачи TSE, определённым в Директиве 2001/83/EC, откорректированной Директивой 2003/63/EC или 2001/82 /EC, выполняя требования, изложенные в «Примечании к руководству по уменьшению риска передачи животной TSE через человеческие и зооветеринарные лечебные продукты». Соответствие принципам снижения риска передачи животной TSE должно быть продемонстрировано путём получения сертификата пригодности, выданного EDQM, или обеспечением полных научных данных по продукту, как обусловлено в приложении II Резолюции AP-CSP (99) 4 (принято Комитетом по здравоохранению).
5.5 Продукты, полученные из биотехнологии
ГЛП, полученные из биотехнологии, должны соответствовать всем релевантным директивам, относимым к биотехнологии, учитывая риск загрязнения случайными примесями, через рекомбинантную колонию клеток, используемую для производства (CPMP/ICH/139/95 Руководства «Анализ создания экспрессии в колониях клеток, используемых для производства продуктов протеина из р-ДНК»). Также, когда используют колонию клеток, эта колония должна быть полностью охарактеризована согласно релевантным требованиям, например, CPMP/ICH/294/95 Руководства «Происхождение и характеристика клеточных субстратов, используемых для продукции биотехнологических/биологических продуктов»; CPMP/ICH/295/95 Руководство «Оценка вирусной безопасности продуктов биотехнологии, полученных из колоний клеток человеческого или животного происхождения» и/или руководства для производства и контроля за иммунологическими ветеринарными лечебными продуктами Том 7 В Eudralex. Если релевантно, CVMP/743/00 «Примечание к руководству по требованиям и контролю, применяемым к бычьей сыворотке (фетальной или телёнка), используемой в производстве иммунологических ветеринарных продуктов», также должны быть учтены.
6. Оценка риска ГЛПБП
Оценка риска, учитывая все факторы, которые могут влиять на потенциальную передачу инфекционных агентов получателям, должна быть выполнена согласно основам Европейской Фармакопеи (5.1.7). Оценка риска учитывает происхождение вида, ткани и клеток, ступени производства и предназначенное использование.
Вирусное загрязнение ГЛП может возникнуть из исходного материала или из случайных веществ, попавшихся во время производственного процесса. Если риск загрязнения существует, три главных дополнительных подхода можно предпринять для того, чтобы контролировать потенциальное вирусное загрязнение лечебного продукта:
- Выбор исходных материалов и тестирование на вирусные загрязняющие элементы, когда считают, что есть человеческие патогены.
- Тестирование возможностей производственного процесса удалять и/или деактивировать вирусы до первого безопасного продукта.
- Тестирование на вирусное загрязнение, считающееся важным на соотвествующих этапах производства.
Оценка риска должна быть выполнена, учитывая:
- происхождение вида,
- орган, ткань, жидкость,
- потенциальные загрязняющие элементы в происхождении первоначального материала, и возможность ношения человеческих патогенов, предпочтительно включая данные поля,
- потенциальные загрязняющие элементы из процесса производства, из рискованных материалов, используемых во время производства, например, энзимов, культурных сред и т.д.
- инфективность и патогенность потенциальных загрязняющих элементов для предназначенных получателей гомеопатического продукта, учитывая протокол назначения,
- контроль за первоначальным материалом и первым безопасным продуктом.
Австралия требует следующую информацию на этикетке (1,2):
• название продукта и название всех активных ингредиентов в товарах (т.е. название активного ингредиента или вещества, из которого было приготовлено разведение)
• гомеопатическую потенцию
• название формы дозировки
• количество товаров
• предупреждающие заявления - если применимо
• номер серии
• срок годности и хранения
• указания по использованию
• название и адрес гаранта или поставщика
• указание цели, для которой предназначено средство (кроме случая, когда товары поставлены в единственном числе практикующему врачу «только для практикующего врача»)
• указание: «гомеопатический продукт» или «гомеопатический препарат».
Канада требует следующую информацию на этикетке (3,4) на внутренней/наружной этикетке, согласно документу по Указанию обозначений на этикетке, и документу «Данные о ГС»:
• Фирменное наименование должно быть на главной индикаторной панели.
• Приставка «DIN-HM» после номера из 8 чисел должна быть на главной индикаторной панели.
• Форма дозировки должна быть на главной индикаторной панели.
• Слово «стерильное» (только для стерильных продуктов) должно быть на главной индикаторной панели.
• Слова «гомеопатическое средство», «гомеопатический препарат», «гомеопатическое лкарство» должны быть на главной индикаторной панели.
• Список всех лекарственных ингредиентов, включая собственное имя и общепринятое имя, если разные.
• Чистый вес в контейнере (например, 5 ампул), указывая вес, дозировку, или количество на главной индикаторной панели.
• Имя и адрес держателя лицензии продукта, включая имя компании и почтовый код (или индекс).
• Название и адрес импортёра, включая название компании и почтовый код.
• Гомеопатическая потенция (например, 5CH) каждого лекарственного ингредиента.
• Метрическое количество (например, 5 г) каждого разведения.
• Рекомендованное использование или цель (особые заявки должны быть поддержаны доказательством).
• Рекомендованные условия использования, включая рекомендованную дозу, пути назначения, продолжительность приёма, форму дозировки, указания по использованию, частоту, субпопуляцию и данные о риске (предосторежения, предупреждения, противопоказания, неблагоприятные реакции).
• Термин «источник» или «первичная информация», предшествующий адресу вебсайта, даёт соединение с вебсайтом NHPD. База данных, перечисляющая собственные и обычные названия ГС, а также полная информация об источнике, как в принятых гомеопатических Фармакопеях, будут опубликованы на вебсайте NHPD в ближайшее время.
• Описание исходного материала для каждого лекарственного ингредиента, как записано на форме для заявления по лицензированию продукта. Как альтерантива, источник информации может быть доступен потребителю через вебсайт, как продолжение этикетки. Если выбрана эта альтернатива, то необходимо, чтобы этикетка включала термин «источник» или «информация об источнике», за чем следует или вебсайт NHPD (www.hc-sc.gc.ca/dhp-mps/prodnatur/index_e.html), или вебсайт компании или ассоциации, которая служит соединением с вебсайтом NHPD. Перечисления в базе данных собственных и общепринятых названий ГС, а также полная информация об источнике, как указано в принятых гомеопатических Фармакопеях, будут опубликованы на вебсайте NHPD в ближайшее время.
• Рекомендованные условия хранения, согласно Гомеопатической фармакопее США (HPUS) (5) должны находиться на этикетке для растворов в глаза/нос: «Храните от света», «Не касайтесь кончика капельницы» и «Не используйте более 4 недель после вскрытия».
• Номер серии, предшествующий одному из следующих обозначений: «Номер серии», «No серии», «Серия», или «С» и срок годности.
• Ссылка на безопасность пакета продукта должна быть на этикетке, если её нет в упаковке продукта. Примерами безопасности упаковки являются запечатывание, прозрачные обёртки и крышки, которые запечатаны до вскрытия.
• Список общепринятых названий всех нелекарственных ингредиентов, под рубрикой «Нелекарственные ингредиенты» (должен быть только на наружной этикетке).
• Количество ртути, которое содержит продукт (должен быть только на наружной этикетке) (требуется только, если продукт содержит ртуть или её соли, или производные, как нелекарственные ингредиенты).
Евросоюз требует следующую информацию на этикетке (6):
• название «гомеопатический продукт»
• регистрационний номер • научное имя сырья • степень разведения (используя символы Фармакопеи) • имя и адрес регистрации и, где возможно, производителя • метод назначения • срок годности • фармацевтическая форма • содержание торговой презентации • специальные меры предосторожности хранения, если есть • специальное предупреждение, если применимо • номер серии (партии) изготовителя • формулировка (заявление): «гомеопатический продукт без утверждённых терапевтических показаний» • предупреждение, советующее потребителю консультацию с врачом, если симптомы сохраняются во время использования лечебного продукта. Индия требует следующую информацию на этикетке (7):
• этикетка внутри контейнера имеет слова «гомеопатическое средство»
• название средства • потенция гомеопатического средства • название каждого ингредиента вместе с потенцией и пропорцией, выраженной в метрических единицах, в случае двух или более ингредиентов • имя и адрес изготовителя • содержание алкоголя, выраженное как процент объёма, в случае этилового спирта, кроме того, когда всё количество ГС в контейнере 30 мл или менее • в случае материнской настойки, нужна дополнительная информация: - чёткий номер серии, ему предшествуют слова «№ партии» «Партия», «№ серии» или «Серия» или «Серия №» или любая чёткая приставка; - номер лицензии на право производства, ему предшествуют слова «Номер лицензии на право изготовления» или Mfg. Lic. No» или «M.L.» • никакого патентованного названия не надо, если ГС содержит один ингредиент. Швейцария требует следующую информацию на этикетке (8).
• название продукта (для однокомпонентных ГС: общепринятое или научное название активного вещества и потенции, для гомеопатических комбинаций: общепринятое название хотя бы одного активного вещества с дополнением, например «comp» (добавление)
• дополнение «гомеопатический лечебный продукт» • форма дозировки • содержание розничного пакета • качественное и количественное обозначение всех активных веществ, обозначение наполнителей • имя и адрес регистрации • номер партии изготовителя • необязательное заявление: «Для индивидуальной терапии, использование и дозировка согласно рекомендации специалиста - гомеопата» • информация об особом риске (предостережения, предупреждения, противопоказания – если есть) • срок годности • условия хранения • номер разрешения. Соединенные Штаты Америки: Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (9) требует следующую информацию
• название и место бизнеса (изготовление, упаковщик или распространитель)
• указания по использованию • заявление идентичности • хотя бы одно главное показание ОТС для использования • заявление ингредиентов (качество и потенция продукта, например 3x) • должна быть обеспечена документация, что эти продукты или ингредиенты, которые не признаны официально в HPUS, признаны как гомеопатические продукты или ингредиенты • установленное названное (английские названия обязательны, латинские названия также м.б. даны) • размер контейнера и количество чистого веса • предупреждения. Гомеопатическая фармакопея Соединенных Штатов (HPUS) (6) требует:
• указания по использованию • заявление идентичности • потенция ГС • содержание чистого веса • имя и место бизнеса изготовителя, упаковщика или распространителя • Национальный кодовый номер (NDC) лекарства или номер, установленный FDA • «Гомеопатическое» обозначение (и, по возможности, «HPUS», если сделано согласно существующим статьям и методам HPUS) • соответствующие указания по использованию. 1. Therapeutic Goods Administration. Australian Regulatory Guidelines for Complementary Medicines. Part 1. Registration of Complementary Medicines (2005).
2. Therapeutic Goods Administration. General requirements for labels for medicines. Therapeutic Goods Act 1989 №69 (2001).
3. Health Canada. Evidence for Homeopathic Medicines Guidance Document (2007).
4. Health Canada. Labelling Standard Homeopathic Preparations (1997); Natural Health Products Regulations, SOR/2003-196.
5. Homoeopathic Pharmacopoeia of the United States. Southeastern. PA, (HPUS) Homeopathic Pharmacopoeia of the USA (www.hpus.com).
6. European Comission Directive 2001/83/EC of the European Parliament and the Council on the Community code relating to medicinal products for human use (2001) amended by Directive 2004/27/EC of the European Parliament and the Council. Chapter 2. Specific provisions applicable to homeopathic medicinal products. Official Journal, L311 (28.11.2001).
7. (India) Drugs and Cosmetics Act, 1940, as amended 2005 (Part IX-A).
8. Ordinance of the Swiss Agency for Therapeutic Products of 9 November 2001 on the requirements relating to the authorization of the placing on the market of medicines (AMZV). Annex 1a (homeopathic or anthroposophic products without therapeutic indication).
9. US Food and Drug Administration, FDA: Act 201 section 502, 503 CFR; FDA/ORA CPG 7132.15.
Австралия (1)
Австралийское государство и правительство Новой Зеландии пытаются согласовать системы государственного регулирования, создавая новое совместное Управление, которое заменит Руководство по терапевтическим товарам Австралии (TGA) и Управление по безопасности лекарств и медицинских приборов Новой Зеландии (Medsafe). Законодательство, относимое к ГС, всё ещё разрабатывают. В настоящее время ГС признаны как средства с малым риском, и могут содержать ингредиенты лишь из опубликованного списка разрешённых ингредиентов; не могут содержать непредусмотренных лекарств; не должны быть стерильными; и не предназначены для использования в профилактике или лечении серьёзного заболевания. Нет нужды, чтобы лекарства класса 1 были оценены на безопасность и качество, но они должны соответствовать некоторым законодательным требованиям; содержать только вещества, ранее одобренные и произведенные лицензированным изготовителем. ГС, за некоторым исключением, могут быть не зарегистрированными, и не подлежат некоторым требованиям GMP, если все ингредиенты разведены больше, чем 1000-кратное серийное разведение материнской настойки; не требуется, чтобы препарат был стерильным; если он не содержит ингредиенты человеческого происхождения, или зарегистрированных частей животных.
Канада (2-5)
ГС контролируют как натуральные лечебные продукты, и продают в розницу. Правила по изготовлению включают производство, упаковку, маркировку, хранение, импорт, распределение, сбыт и клинические испытания. Ингредиенты должны быть зарегистрированны хотя бы в одной из гомеопатических Фармакопей, принятых NHPD: Гомеопатическая Фармакопея Соединенных Штатов (6), Немецкая гомеопатическая Фармакопея (7), Французская Фармакопея (8), Европейская Фармакопея (9), Энциклопедия гомеопатических Фармакопей (10).
Есть критерии для лекарств, не принятых как ГС: назначаемые проколами кожи; лекарства, полученные из веществ в Списке I-IV «Постановления по контролю за лекарствами и веществами (наркотические ингредиенты)»; и лекарства, полученные из веществ в Списке С «Постановления о продуктах питания и лекарствах» (радиоактивные лекарственные вещества). ГС должны отвечать спецификациям (требованиям) GMP. Для всех ГС лицензирование должно быть удостоверено восьмизначным идентификационным номером, предшествующим буквам DIN-HM. Заявитель на лицензию должен обеспечить информацию обо всех ингредиентах продукта, о безопасности продукта, на тексте предложенной этикетки и рекомендованных условиях использования.
Европейский союз (11).
ГЛП регулируют согласно Директиве 2001/83/EC, которую применяют к промышленно произведенным лечебным продуктам для использования человеком - специальные постановления применяют к ГЛП относительно упрощённой процедуры регистрации и доказательства терапевтической эффективности. ГЛП разделены на две категории: 1) ГЛП, зарегистрированные по «упрощённой процедуре», предназначают для перорального или внешнего применения, без терапевтических показаний на этикетке, и препараты представляют собой разведение хотя бы 1:10000 материнской настойки; такие продукты проходят по ст. 14 Директивы 2001/83/EC (упрощённая процедура регистрации); никакого доказательства терапевтической эффективности для этих продуктов не нужно; 2) все другие ГЛП, не отвечающие критериям регистрации по упрощённой процедуре; менее разведенные, чем 1:10000; не предназначенные для перорального или внешнего применения; или реализуемые по определённому показанию как продукты ухода; проходят по Ст. 16 Директивы 2001/83/EC (процедуры по сбыту).
Качество и безопасность исходного материала, материнской настойки и утверждённых ГЛП должны соответствовать Европейскому законодательству по лечебным продуктам и стандартам Европейской Фармакопеи. Качество и нормы безопасности ГЛП гарантированы законодательством и директивами по GMP (Директива 2003/94/EC), осмотром и наблюдением, обозначением на этикетке, листком-вкладышем и продажей.
Индия (12-15)
Гомеопатия принята как одна из национальных систем медицины в Индии. Гомеопатическая Фармакопея Индии (16) включает: принципы и стандарты изготовления; тесты на идентичность, качество и очищенность; гомеопатический фармацевтический кодекс; и статьи ГС. Гомеопатическая фармакопейная лаборатория устанавливает стандарты и выполняет испытания (как национальная лаборатория) на идентичность, очищенность и качество ГС. Цели GMP включают специальные аспекты помещений, штат, завод и оборудование для изготовления ГС.
ГС покупают только у торговца или изготовителя, лицензированных согласно Правилам 1945 г. о лекарствах и косметике. ГС, содержащие более чем 12% (этиловый спирт) в/в, не будут упакованы и продаваться в пакетах или бутылках более 30 мл, но их могут продавать в стационары или профилактории, в пакетах или бутылках, ёмкостью более 100мл.
Швейцария (17)
ГЛП упорядочены согласно их специфическим характеристикам и рискам.
• Упрощённое разрешение для продуктов с терапевтическими показаниями требует полного досье, включая доказательства качества, безопасности и эффективности.
• Упрощённое разрешение для продуктов без терапевтических показаний подразделяют на 3 категории:
1. Упрощённое разрешение для продуктов с выдуманными/фирменными названиями и/или с дозировкой: полное досье, включая доказательство качества, безопасности и клинической переносимости, но без задокументированной эффективности.
2. Упрощённое разрешение с уменьшенным досье: необходимо представить в дополнение к общей документации (включая элементарные сведения) уменьшенную специфическую документацию для ГС.
3. Официальная процедура по заявлению на использование (применяемая в большинстве случаев):
• представление основного досье компании, содержащее суммированную информацию и подтверждения, относимые к изготовителям и к лечебным продуктам;
• электронное представление индивидуальной регистрации каждого вещества и формы дозировки с элементарными сведениями, т.е. упоминание производственного процесса и исходного материала;
• дополнительная документация необходима лишь в случае ряда веществ животного или человеческого происхождения, или для лечебных продуктов, назначаемых парентрально или накладываемых на глаза или в глазную щель: отдельное совместное представление досье на все лечебные продукты.
Есть обширный список исходных материалов и активных веществ (anthroposophischer Stoffe und homoopathischer Liste (список HAS)), определяющий, какая из процедур применима к определённому лечебному продукту без показаний. Список содержит те вещества, для которых Агенство имеет доказательство, что их использование можно увидеть как традиционное внутри гомеопатии (или антропософских средств). Он также содержит потенции для веществ, безопасность которых была доказана до такой степени, что все, или хотя бы некоторые, детали из документации по качеству и безопасности не нужно представлять. Список регулярно корректируют, и он может быть расширен.
Основой для качества служат Директивы по GMP (Директива 2003/94/EC (18)), осмотры и наблюдение. Принятыми стандартами служат Европейская Фармакопея (PhEur) (9), Щвейцарская Фармакопея (19), Немецкая гомеопатическая Фармакопея (GHP) (7), глава по гомеопатии Французской Фармакопеи (PhF) (8), некоторые специфические производственные процессы Британской гомеопатической Фармакопеи (BHP) (20) и, в ряде случаев, статьи по веществам Гомеопатической Фармакопеи Соединенных Штатов (HPUS) (6).
Соединенные Штаты Америки (21,22).
Официальные гомеопатические продукты классифицируют как лекарства, которые должны иметь статью в Гомеопатической Фармакопее США (HPUS) (6), в отличие от неофициальных ГС, которые могут продавать, если ингредиенты всеми признаны как гомеопатические. FDA различает официальные (HPUS-зарегистрированные ингредиенты) и неофициальные гомеопатические препараты; оба - законные. Приемлемость для включения в HPUS требует, чтобы было доказано, что гомеопатический продукт безопасен, эффективен и приготовлен согласно требованиям HPUS.
Гомеопатические продукты должны соответствовать стандартам качества и очищенности, установленным HPUS. Присутствие аббревиатуры HPUS на этикетке продукта гарантирует, что соблюдены правовые стандарты силы, качества, очищенности и упаковки. Гомеопатические продукты, предназначенные исключительно для заболеваний, проходящих без лечения, согласно самодиагностике и лечению, могут продаваться как OTC (средства безрецептурного отпуска). Гомеопатические продукты, которые не входят в OTC, необходимо продавать как средства, отпускаемые по рецепту.
Гомеопатические продукты должны быть изготовлены в соответствии с GMP, но для них нет необходимости указывать срок годности, штамп на таблетке, лабораторные параметры идентичности и силы. Требования стабильности должны отвечать письменной оценке на совместимость ингредиентов и наполнителей, и на возможный распад за предпологаемый период времени.
1. Therapeutic Goods Administration. Australian Regulatory Guidelines for Complementary Medicines. Part I-V. Symonston, ACT. Australian Government. Department of Health and Ageing. Therapeutic Goods Administration (2005).
2. Health Canada. Natural Health Products Directorate. Food and Drugs Act, Natural Health Products Regulations, SOR/2003-196 (2003).
3. Health Canada. Natural Health Products Directorate. Overview of the Natural Health Products Regulations Guidance Document (2003).
4. Health Canada. Natural Health Products Directorate. GMP Guidance Document (2003).
5. Health Canada. Natural Health Products Directorate. Evidence for Homeopathic Medicines Guidance Document (2007).
6. Homoeopathic Pharmacopoeia of the United States. Southeastern. PA, (HPUS) Homeopathic Pharmacopoeia Convention of the United States (www.hpus.com).
7. German Homeopathic Pharmacopoeia (GHP) Vols 1&2. Stutgart, Medpharm Scientific Publishers, 2006.
8. Pharmacopee Francaise [French Pharmacopoeia]. Vol. 3, 10th Ed. Refondue + Mise A Jour 2003 + Liste Des Plantes Medicinale, Agence Medicame, 2003.
9. Council of Europe. European Pharmacopoeia, 6th ed. Strasbourg, Directorate for the Quality of Medicines of the Council of Europe, 2006.
10. Varma, PN. Vaid I. Encyclopedia of homeopathic pharmacopoeia, 4 vols. New Delhi, Jain, 2007.
11. European Comission Directive 2001/83/EC of the European Parliament and the Council on the Community code relating to medicinal products for human use (2001) amended by Directive 2004/27/EC of the European Parliament and the Council. Chapter 2. Specific provisions applicable to homeopathic medicinal products. Official Journal, L311 (28.11.2001).
12. The Homoeopathy Central Council Act 1973 (№59 of 1973). Department of Ayurveda, Yoga & Naturopathy, Unani, Siddha and Homeopathy, Annual Report 2000-2001. Chapter 2. Ministry of Health & Family Welfare, Government of India.
13. The Homoeopathy Central Council (amended) 2002 (№51 of 2002).
14. Drugs and Cosmetics Act, 1940, as amended 2005. Shedule M (GMP) of Drugs and Cosmetics Act.
15. Ministry of Health & Family Welfare, Government of India. Shedule M (GMP) of Drugs and Cosmetics Rules, as amended 2006.
16. Homoeopathic Pharmacopoeia of India. Delhi. Vol. 1-8. Controller of Publications. 1970-2001.
17. Verondnung vom 22. Juni 2006 des Schweizerischen Heilmittelinstituts uber die vereinfachte Zulassung von Komplementar und Phytoarzneimitteln (Komplementar und Phytoarzneimittelverordnung. KPAV).
18. Directive 2003/94/EC of the European Parliament and the Council. Principles and guidelines of GMP in respect of medicinal products for human use and investigational products for human use Official Journal I.262,14/10/2003/:22-6.
19. Schweizerischen Pharmakopoe [Swiss Pharmacopoeia] (Ph Helv). 10th ed. Berne, Department of the Interior, 2006.
20. British homeopathic Pharmacopoeia. London. British Homoeopathic Society, 1876.
21. US Food and Drug Administration, FDA: Compilance Policy Guide, CPG, 712.15. Sec. 400.400; 21 CFR Parts 210&211, as amended.
22. 21 Code of Federal Regulations. Parts 210 and 211: Current GMP in manufacturing, processing, packing or holding of drugs; general and current GMP for finished pharmaceuticals. Rockville, MD. US FDA, 2006 (http://www.fda.gov/cder/dmpq/cgmpregs.htm).
Вопросы безопасности в приготовлении гомеопатических средств (ВОЗ)
Материал содержит важнейший на сегодня документ ВОЗ по безопасности гомеопатических препаратов, принятый и опубликованный в 2010 году. В работе над документом приняли участие около 400 экспертов и организаций. Каждый из разделов содержит необходимые ссылки и библиографию.
Питання безпеки у виготовленні гомеопатичних засобів (ВООЗ)
Матеріал утримує найважливіший насьогодні документ ВООЗ з безпеки гомеопатичних ліків, що був прийнятий та опублікований у 2010 році. У роботі над документом брали участь близько 400 експертів та організацій. Кожний з розділів має необхідні посилання на бібліографію.
|
|||||||
Медицинский портал о гомеопатии и гомеопатах, в Одессе и мире. Прочтете все про лечение гомеопатией! Найдете центр гомеопатии. Гомеопатия аптека и гомеопатия форум. Гомеопатия в Украине
|
||||||||